RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 20/02/2023
NEXOCET 4 mg/mL, poudre pour suspension buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
4 mg/mL : Après reconstitution, chaque mL de suspension buvable contient 4 mg d’oméprazole. Chaque flacon reconstitué (90 mL) contient 360 mg d’oméprazole.
Excipients à effet notoire :
Chaque mL de suspension contient du parahydroxybenzoate de méthyle sodique (E219) 2,3 mg, du maltitol (E965) 272 mg, du benzoate de sodium (E211) 5 mg, du sodium 17,2 mg et du potassium 64,3 mg.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour suspension buvable
Poudre dans la capsule : poudre blanche/blanc-cassé/légèrement jaune
Poudre dans le flacon : poudre blanche/blanc-cassé/légèrement jaune pouvant contenir des grains noirs dus à un édulcorant.
4.1. Indications thérapeutiques
NEXOCET 4 mg/mL, poudre pour suspension buvable est indiqué pour :
Adultes
· Traitement des ulcères duodénaux
· Prévention de la récidive des ulcères duodénaux
· Traitement des ulcères gastriques
· Prévention de la récidive des ulcères gastriques
· En association avec des antibiotiques appropriés, en traitement d’élimination des ulcères peptiques à Helicobacter pylori (H pylori)
· Traitement des ulcères gastriques et duodénaux associés aux AINS
· Prévention des ulcères gastriques et duodénaux associés aux AINS pour les patients à risque
· Traitement des reflux œsophagiens
· Traitement chroniques des patients guéris après un reflux œsophagien
· Traitement des reflux gastro-œsophagiens symptomatiques.
Usage pédiatrique
Enfants de plus d’1 mois
· Traitement des reflux œsophagiens
· Traitement symptomatique de brûlures d’estomac et de régurgitations acides dans le cadre d’un reflux gastro-œsophagien.
Enfants de plus de 4 ans et adolescents
Associé à des antibiotiques dans le traitement des ulcères duodénaux causés par H.pylori.
4.2. Posologie et mode d'administration
NEXOCET 2 mg/mL, poudre pour suspension buvable est adapté à des doses inférieures à 15 mg. Pour des doses de 20 mg ou plus, il est préférable d’utiliser NEXOCET 4 mg/mL, poudre pour suspension buvable.
Posologie chez les adultes
Traitement des ulcères duodénaux
La dose recommandée pour des patients atteints d’un ulcère duodénal actif est une dose d’oméprazole 20 mg par jour en une prise. Chez la plupart des patients, un délai de deux semaines est nécessaire pour la guérison. Pour les patients qui ne seraient pas complètement guéris après ce délai, la guérison peut demander encore deux semaines supplémentaires de traitement. Pour les patients souffrant d’ulcères duodénaux peu sensibles, il est recommandé une dose d’oméprazole 40 mg par jour en une prise permettant habituellement une amélioration en 4 semaines.
Prévention de la récidive des ulcères duodénaux
Pour la prévention de la rechute des ulcères duodénaux avec la bactérie H pylori ou quand l’élimination de la bactérie H.pylori n’est pas possible, la dose recommandée d’oméprazole est de 20 mg par jour en une prise. Chez certains patients, une dose journalière de 10 mg peut suffire. En cas d’échec thérapeutique, la dose peut être augmentée jusqu’à 40 mg.
Traitement des ulcères gastriques
La dose d’oméprazole recommandée est de 20 mg par jour en une fois. Chez la plupart des patients, la guérison intervient dans les quatre semaines. Pour les patients qui ne seraient pas complètement guéris après ce délai, la guérison peut demander encore quatre semaines supplémentaires de traitement. Pour les patients souffrant d’ulcères duodénaux peu sensibles, l’oméprazole est recommandé à raison de 40 mg par jour en une prise, et la guérison intervient, généralement au bout de huit semaines.
Prévention de la récidive des ulcères gastriques
Pour la prévention de la rechute de patients présentant des ulcères gastriques peu sensibles, la dose recommandée d’oméprazole est de 20 mg par jour en une prise. Si besoin, la dose d’oméprazole peut être augmentée jusqu’à 40 mg par jour.
Elimination de la bactérie H pylori dans les ulcères peptiques.
Pour l’élimination de la bactérie H pylori le choix des antibiotiques doit être adapté à la tolérance du patient pour les médicaments, et réalisé selon les modèles de résistance et recommandations de traitement nationaux, régionaux, et locaux.
· Oméprazole 20 mg + clarithromycine 500 mg + amoxicilline 1,000 mg, deux fois par jour pendant une semaine ou
· Oméprazole 20 mg + clarithromycine 250 mg (ou 500 mg) + métronidazole 400 mg (ou 500 mg ou 500 mg de tinidazole) deux fois par jour pendant une semaine ou
· 40 mg d’oméprazole une fois par jour avec 500 mg d’amoxicilline et 400 mg de métronidazole (ou 500 mg ou 500 mg de tinidazole) jusqu’à trois fois par jour pendant une semaine.
Pour chaque schéma posologique, si le patient est encore positif à H.pylori, le traitement peut être répété.
Traitement des ulcères gastriques et duodénaux associés aux AINS
Pour le traitement des ulcères gastriques et duodénaux associés aux AINS, la dose recommandée d’oméprazole est de 20 mg par jour. Chez la plupart des patients, la guérison intervient dans les quatre semaines. Pour les patients qui ne seraient pas complètement guéris après ce délai, la guérison peut demander encore quatre semaines supplémentaires de traitement.
Prévention des ulcères gastriques et duodénaux associés aux AINS pour les patients à risque
Pour la prévention des ulcères gastriques ou duodénaux associés aux AINS, chez les patients à risque (âgés de plus de 60 ans avec des antécédents d’ulcères gastriques ou duodénaux, ou d’hémorragies digestives), la dose d’oméprazole recommandée est de 20 mg par jour.
Traitement des reflux œsophagiens
La dose d’oméprazole recommandée est de 20 mg par jour en une fois. Chez la plupart des patients, la guérison intervient dans les quatre semaines. Pour les patients qui ne seraient pas complètement guéris après ce délai, la guérison peut demander encore quatre semaines supplémentaires de traitement.
Pour les patients atteints d’une œsophagite sévère, la dose recommandée d’oméprazole est de 40 mg par jour et la guérison intervient, en général, dans les huit semaines.
Traitement chroniques des patients guéris après un reflux œsophagien
Pour le traitement à long terme de patients guéris de reflux œsophagien, la dose recommandée d’oméprazole est de 10 mg par jour. Si besoin, la dose d’oméprazole peut être augmentée jusqu’à 20 ou 40 mg par jour.
Traitement des reflux gastro-œsophagiens symptomatiques.
La dose d’oméprazole recommandée est de 20 mg par jour. Certains patients peuvent très bien réagir avec seulement 10 mg par jour. C’est pourquoi la dose doit être adaptée selon chaque patient.
En l’absence d’amélioration des symptômes après quatre semaines de traitement avec oméprazole 20 mg par jour, des examens complémentaires sont conseillés.
Population pédiatrique
Enfants de plus d’1 mois
Traitement des reflux œsophagiens
Traitement symptomatique de brûlures d’estomac et de régurgitations acides dans le cadre d’un reflux gastro-œsophagien
Les posologies recommandées sont les suivantes :
|
Âge |
Poids |
Dose |
|
De 1 mois à 1 an |
|
1 mg/kg une fois par jour. Les doses supérieures à 1,5 mg/kg/jour n'ont pas été étudiées. |
|
³ 1 an |
10-20 kg |
10 mg une fois par jour. Si besoin, la dose d’oméprazole peut être augmentée jusqu’à 20 mg par jour si besoin. |
|
³ 2 ans |
>20 kg |
20 mg une fois par jour. Si besoin, la dose d’oméprazole peut être augmentée jusqu’à 40 mg par jour si besoin. |
Note : Les dosages de 2 mg/mL et 4 mg/mL sont mesurés par rapport à la capacité tampon (même quantité tampon sur une base en mL). Pour des doses inférieures ou égales à 15 mg, le dosage de 2 mg/mL est recommandé. Le dosage de 2 mg/mL est indiqué pour un âge compris entre 1 mois et 1 an pour administrer jusqu’à 15 mg et à partir de 1 an pour administrer 10 mg pour permettre la capacité et l’absorption suffisantes. Pour des doses de 20 mg ou 40 mg, le dosage de 4 mg/mL convient. Le dosage de 4 mg/mL est indiqué pour l’administration de 20 mg ou 40 mg. Ainsi 2 doses au maximum sont nécessaires.
Reflux œsophagien : La durée de traitement varie entre 4 et 8 semaines.
Traitement symptomatique de brûlures d’estomac et de régurgitations acides dans le reflux gastro-œsophagien : La durée de traitement varie entre 2 et 4 semaines. Si l’amélioration des symptômes n’est pas constatée dans un délai de 2 à 4 semaines, des examens complémentaires sont recommandés.
Enfants de plus de 4 ans et adolescents
Traitement des ulcères duodénaux dus à la bactérie H pylori
Pour choisir le schéma thérapeutique approprié, il conviendra de prendre en compte les directives officielles nationales, régionales et locales concernant la résistance de la bactérie, la durée du traitement (en général 7 jours mais pouvant aller jusqu’à 14 jours) et l’usage adéquat des agents antibactériens.
Le traitement devra être surveillé par un spécialiste.
Les recommandations pour la posologie sont les suivantes :
|
Poids |
Dose |
|
15-30 kg |
En association avec deux antibiotiques : 10 mg d’oméprazole, 25 mg/kg d’amoxicilline en fonction du poids corporel et 7,5 mg/kg de clarithromycine en fonction du poids corporel peuvent être administrés ensemble deux fois par jour pendant une semaine. |
|
31-40 kg |
En association avec deux antibiotiques : 20 mg d’oméprazole, 750 mg d’amoxicilline et 7,5 mg/kg en fonction du poids corporel de clarithromycine peuvent être administrés ensemble deux fois par jour pendant une semaine. |
|
> 40 kg |
En association avec deux antibiotiques : 20 mg d’oméprazole, 1 g d’amoxicilline et 500 mg de clarithromycine peuvent être administrés ensemble deux fois par jour pendant une semaine. |
Populations particulières
Insuffisance rénale
Il n’est pas nécessaire d’adapter la dose pour les patients atteints d’insuffisance rénale (voir rubrique 5.2)
Insuffisance hépatique
Pour des patients atteints d’insuffisance hépatique, une dose quotidienne de 10-20 mg peut s’avérer suffisante (voir rubrique 5.2).
Personnes âgées (de plus de 65 ans)
L’adaptation de la dose n’est pas nécessaire pour les personnes âgées (voir rubrique 5.2).
Mode d’administration
NEXOCET 4 mg/mL, poudre pour suspension buvable doit être pris à jeun, 30 minutes avant un repas.
Précautions à prendre avant de manipuler ou d’administrer le médicament
NEXOCET 4 mg/mL, poudre pour suspension buvable doit être reconstitué avant toute administration orale. Pour les instructions concernant la reconstitution du médicament avant administration, voir rubrique la 6.6.
Pour les instructions concernant l’administration par une sonde nasogastrique (NG), gastrostomie endoscopique percutanée (PEG), voir rubrique 6.6.
L’oméprazole comme tous les inhibiteurs de la pompe à protons (IPP) ne doit pas être utilisé en association avec le nelfinavir (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
L’administration concomitante d’atazanavir et d’inhibiteur de la pompe à protons (IPP) est déconseillée (voir rubrique 4.5) Si l’association de l’atazanavir et de l’inhibiteur de la pompe à protons (IPP) est inévitable, la surveillance clinique étroite (ex : charge virale) est recommandée en association avec l’augmentation de la dose d’atazanavir jusqu’à 400 mg avec 100 mg de ritonavir, la dose de 20 mg d’oméprazole ne doit pas être dépassée.
L’oméprazole, comme tous les médicaments anti-acides gastriques, peut diminuer l’absorption de vitamine B12( cyanocobalamine) due à une hypo- ou achlorhydrie. Ceci concerne les patients avec des réserves corporelles limitées ou présentant des facteurs de risque de diminution de l’absorption de la vitamine B12 sous traitement de longue durée.
L’oméprazole est un inhibiteur CYP2C19. En début ou fin de traitement avec l’oméprazole, le risque d’interactions avec les médicaments métabolisés par le CYPC219 doit être envisagé. Une interaction avérée existe entre le clopidogrel et l’oméprazole (voir rubrique 4.5) La pertinence clinique de cette interaction est incertaine. Par précaution, l’utilisation concomitante d’oméprazole et de clopidogrel doit être déconseillée.
Une hypomagnésémie sévère a été rapportée chez des patients soignés avec un inhibiteur de la pompe à protons (IPP) comme l’oméprazole depuis au moins trois mois et la plupart du temps un an. De sérieuses manifestations d’hypomagnésémie comme la fatigue, la tétanie, la démence, les convulsions, les étourdissements et l’arythmie ventriculaire peuvent apparaître mais cela peut être insidieux et elles peuvent être négligées. Chez la plupart des patients affectés, l’hypomagnésémie a diminué après une supplémentation en magnésium et l’interruption du traitement par l’IPP.
Pour les patients susceptibles d’être sous traitement prolongé ou prenant un IPP avec de la digoxine ou des médicaments pouvant entraîner une hypomagnésémie (comme les diurétiques), les professionnels de santé veilleront à mesurer le taux de magnésium avant de démarrer le traitement avec l’IPP ainsi que régulièrement pendant ce traitement.
Les inhibiteurs de la pompe à protons (IPP), particulièrement s’ils sont utilisés à haute dose (pendant plus d’un an) peuvent légèrement augmenter le risque de fracture de la hanche, du poignet et de la colonne vertébrale principalement chez les personnes âgées ou en présence de facteurs de risque reconnus. Les études d’observations suggèrent que les inhibiteurs de la pompe à protons (IPP) peuvent augmenter le taux global de fracture de 10 à 40 %. Une part de cette augmentation peut être imputée à d’autres facteurs de risque. Les patients ayant un risque d’ostéoporose doivent bénéficier de soins selon les directives cliniques en vigueur et d’un apport adéquat en vitamine D et en calcium.
Lupus érythémateux cutané subaigu (LECS)
Les inhibiteurs de la pompe à proton sont associés dans de rares cas avec les LECS. Si des lésions se développent, particulièrement sur des parties de la peau exposées au soleil et si elles s’accompagnent d’arthralgie, le patient doit recourir immédiatement à une aide médicale et les professionnels de santé doivent envisager l’arrêt de l’oméprazole. L’apparition d’un LCES après un traitement préventif à base d’inhibiteur de pompe à protons peut augmenter le risque de LCES en présence d’autres inhibiteurs de la pompe à protons.
Interférence avec les analyses de laboratoire
Une augmentation du taux de chromogranine A (CgA) peut interférer avec le diagnostic de tumeurs neuroendocrines. Pour éviter ces interférences, le traitement par oméprazole devra être arrêté pendant un minimum de 5 jours avant de doser la CgA (voir rubrique 5.1) Si le taux de CgA et de gastrine ne sont pas revenus à des taux normaux après une mesure initiale, ces mesures devront être à nouveau effectuées 14 jours après avoir cessé le traitement avec l’inhibiteur de la pompe à protons.
Certains enfants atteints de maladies chroniques peuvent nécessiter un traitement à long terme bien que cela ne soit pas recommandé.
Les traitements aux médicaments réducteurs d’acide peuvent entraîner une légère augmentation du risque d’infections gastro-intestinales comme la Salmonelle et le Campylobacter ainsi que, le Clostridium difficile (voir rubrique 5.1.) chez les patients hospitalisés.
Comme pour tous les traitements à long terme, surtout ceux qui dépassent 1 an, les patients devront rester sous une surveillance régulière.
Ce médicament contient 17,2 mg (0,75 mmol) de sodium par mL ou 86 mg (3,75 mmol) de sodium par dose de 5 mL, équivalant (pour une dose de 5 mL) à 4,3% de la dose journalière maximale recommandée par l’OMS de 2 g de sodium par adulte.
Ce médicament contient 54,3 mg (1,39 mmol) de potassium par mL ou 271,5 mg (6,95 mmol) de potassium pour une dose de 5 mL. Ceci doit être pris en considération pour les patients souffrant d’insuffisance rénale ou dont l’apport en potassium est contrôlé.
Ce médicament contient du parahydroxybenzoate de méthyl sodique qui peut provoquer des réactions allergiques (éventuellement à distance de la prise).
Ce médicament contient 5 mg de benzoate de sodium par mL.
Ce produit contient du maltitol. Les patients souffrant d’intolérance héréditaire rare au fructose, ne doivent pas prendre ce médicament.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Effets de l’oméprazole sur la pharmacocinétique d’autres substances actives
Substances actives avec une absorption pH-dépendante
La diminution de l’acidité intragastrique pendant un traitement à l’oméprazole peut augmenter ou diminuer l’absorption de substances actives avec une absorption pH-dépendante.
Nelfinavir, atazanavir
Les taux plasmatiques du nelfinavir et de l’atazanavir diminuent si elles sont liées à une administration d’oméprazole.
L’administration simultanée d’oméprazole et de nelfinavir est contre-indiquée (voir rubrique 4.3). L’administration concomitante d’oméprazole (40 mg par jour) réduit l’exposition au nelvinavir d’environ 40 % et l’exposition moyenne du métabolite pharmacologiquement actif M8 est diminué d’environ 75 à 90 %. L’interaction peut également entraîner une inhibition du CYPC219.
L’administration concomitante d’oméprazole et d’atazanavir n’est pas recommandée (voir rubrique 4.4) L’administration concomitante d’oméprazole (40 mg par jour) et d’atazanavir 300 mg/ritonavir 100 mg chez des volontaires sains a provoqué une diminution de 75 % de l’exposition à l’atazanavir. L’augmentation de la dose d’atazanavir à 400 mg ne compense pas l’effet de l’oméprazole sur l’exposition à l’atazanavir. L’administration concomitante d’oméprazole (20 mg par jour) et d’atazanavir 400 mg/ritonavir 100 mg à des volontaires sains a entraîné une diminution d’approximativement 30% de l’exposition à l’atazanavir par rapport à l’atazanavir 300 mg/ritonavir 100 mg par jour.
Digoxine
Un traitement concomitant avec de l’oméprazole (20 mg par jour) et de la digoxine chez des sujets sains entraîne une augmentation de la biodisponibilité de la digoxine de 10 %. La toxicité de la digoxine a rarement été signalée. Cependant, des précautions doivent être prises en cas d’administration d’oméprazole à haute dose chez des patients âgés. La surveillance du traitement par la digoxine doit être de ce fait, renforcée.
Clopidogrel
Le résultat d’études menées sur des sujets sains a montré une interaction pharmacocinétique (PK), pharmacodynamique (PD) entre le clopidogrel (dose de charge de 300 mg/75 mg quotidiennement en dose d’entretien) et l’oméprazole (80 mg par jour par voie orale) entraînant une diminution de l’exposition au métabolite actif du clopidogrel de 46 % et une diminution de l’inhibition maximale (induite par l’ADP) de 16 %.
Des données contradictoires sur les conséquences cliniques de cette interaction PK/PD avec l’oméprazole en termes d’évènements cardiovasculaires majeurs ont été rapportées provenant d’études observationnelles et cliniques. Par précaution, l’usage simultané de l’oméprazole et du clopidogrel est déconseillé (voir rubrique 4.4).
Autres substances actives
L’absorption de posaconazole, erlotinib, ketoconazole et itraconazole est réduite de façon significative et donc l’efficacité clinique peut être altérée. Il faut éviter l’absorption conjointe de posaconazole et d’erlotinib avec l’oméprazole.
Substances actives métabolisées par le CYPC219
L’oméprazole est un inhibiteur modéré du CYPC219, la principale enzyme métabolisant l’oméprazole. Ainsi, le métabolisme des substances actives conjointes, également métabolisées par le CYPC219 peut être diminué et l’exposition systémique à ces substances augmentée. Des exemples de tels médicaments sont la R-warfarine et d’autres anti-vitaminiques K, cilostazol, diazépam et phénytoïne.
Cilostazol
Dans une étude en cross over, l’oméprazole administré en doses de 40 mg à des sujets sains a augmenté la Cmax et l’ASC du cilostazol de 18 % et 26 % respectivement et de l’un de ses métabolites actifs de 29 % et 69 % respectivement.
Phénytoïne
Il est conseillé de surveiller la concentration plasmatique de phénytoïne au cours des deux premières semaines suivant le début du traitement par oméprazole. Si un ajustement de la posologie de la phénytoïne est réalisé, une surveillance et des ajustements de doses successifs peuvent être nécessaires jusqu’à la fin du traitement par oméprazole.
Mécanisme inconnu
Saquinavir
L’administration concomitante d’oméprazole et de saquinavir/ritonavir a entraîné une augmentation des concentrations plasmatiques jusqu’à 70 %, associée à une bonne tolérance chez les patients infectés par le VIH.
Tacrolimus
Une augmentation des concentrations sériques du tacrolimus a été signalée lors d’une administration concomitante de tacrolimus et d’oméprazole. Une surveillance renforcée de la concentration du tacrolimus et de la fonction rénale (clairance en créatine) doit être effectuée et la posologie du tacrolimus doit être adaptée, si besoin.
Méthotrexate
Une augmentation des concentrations de méthotrexate a été observée chez certains patients lors d’administration concomitante de méthotrexate avec les inhibiteurs de la pompe à protons. Lors de l’administration de fortes doses de méthotrexate, un arrêt provisoire du traitement par oméprazole peut s’avérer nécessaire.
Effets d’autres substances actives sur la pharmacocinétique de l’oméprazole
Inhibiteurs du CYP2C19 et/ou CYP3A4
Comme l’oméprazole est métabolisé par le CYP2C19 et le CYP3A4, les substances actives connues pour inhiber le CYP2C19 ou le CYP3A4 (telles que la clarithromycine et le voriconazole) peuvent entraîner une augmentation des taux sériques d’oméprazole par diminution de sa métabolisation. Le traitement concomitant par le voriconazole a plus que doublé l’exposition à l’oméprazole. Comme de fortes doses d’oméprazole ont été bien tolérées, il n’est généralement pas nécessaire d’ajuster la dose d’oméprazole. Cependant, un ajustement de la dose doit être envisagé chez les patients présentant une insuffisance hépatique sévère et si un traitement à long terme est indiqué.
Inducteurs du CYP2C19 et/ou CYP3A4
Les substances actives connues pour induire le CYP2C19 ou le CYP3A4 ou les deux (telles que la rifampicine et le millepertuis) peuvent entraîner une diminution des taux sériques d’oméprazole par augmentation de sa métabolisation.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les résultats de trois études épidémiologiques prospectives (plus de 1 000 résultats exposés) n’ont révélé aucun effet indésirable de l’oméprazole sur la grossesse ou la santé du fœtus/nouveau-né. L’oméprazole peut être utilisé pendant la grossesse.
Allaitement maternel
L’oméprazole est excrété dans le lait maternel, mais il est peu probable qu’il y ait une influence sur l’enfant lorsqu’il est utilisé à doses thérapeutiques.
Fertilité
Les études effectuées chez l’animal avec le mélange racémique d’oméprazole administré par voie orale, n’indiquent pas d’effet sur la fertilité.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil d’innocuité
Les effets secondaires les plus courants (1-10% des patients) sont les maux de tête, les douleurs abdominales, la constipation, la diarrhée, les flatulences et les nausées/vomissements.
Liste tabulée des réactions indésirables
Les effets indésirables suivants ont été identifiés ou suspectés dans le programme d’essais cliniques pour l’oméprazole et en post-commercialisation. Aucune de ces réactions n’est dose-dépendante. Les effets indésirables listés ci-dessous sont classés selon la fréquence et par système organe classe (SOC). Les catégories de fréquence sont définies selon les conventions suivantes : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), Rare (≥ 1/10 000 à < 1/1 000), Très rare (< 1/10 000), Fréquence indéterminée (impossible à estimer à partir des données disponibles).
|
SOC/fréquence |
Effet indésirable |
|
Affections hématologiques et du système lymphatique |
|
|
Rares : |
Leucopénie, thrombopénie |
|
Très rares : |
Agranulocytose, pancytopénie |
|
Affections du système immunitaire |
|
|
Rares : |
Réactions d’hypersensibilité par exemple de la fièvre, un œdème de Quincke et une réaction/un choc anaphylactique |
|
Troubles du métabolisme et de la nutrition |
|
|
Rares : |
Hyponatrémie |
|
Fréquence indéterminée : |
Hypomagnésémie ; une hypomagnésémie sévère peut conduire à une hypocalcémie. L’hypomagnésémie peut également être associée à l’hypokaliémie. |
|
Affections psychiatriques |
|
|
Peu fréquents : |
Insomnie |
|
Rares : |
Agitation, confusion, dépression |
|
Très rares : |
Agressivité, hallucinations |
|
Affections du système nerveux |
|
|
Fréquents : |
Maux de tête |
|
Peu fréquents : |
Étourdissements, paresthésie, somnolence |
|
Rares : |
Troubles gustatifs |
|
Affections oculaires |
|
|
Rares : |
Vision trouble |
|
Affections de l’oreille et du labyrinthe |
|
|
Peu fréquents : |
Vertiges |
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Rares : |
Bronchospasme |
|
Affections gastro-intestinales |
|
|
Fréquents : |
Douleur abdominale, constipation, diarrhée, flatulences, nausée/vomissements, polypes des glandes fundiques (bénins) |
|
Rares : |
Bouche sèche, stomatite, candidose intestinale |
|
Fréquence indéterminée : |
Colite microscopique |
|
Affections hépatobiliaires |
|
|
Peu fréquents : |
Augmentation des enzymes hépatiques |
|
Rares : |
Hépatite avec ou sans jaunisse |
|
Très rares : |
Insuffisance hépatique, encéphalopathie chez les patients souffrant d’une maladie hépatique préexistante |
|
Affections de la peau et du tissu sous-cutané |
|
|
Peu fréquents : |
Dermatites, prurit, éruption cutanée, urticaire |
|
Rares : |
Alopécie, photosensibilité |
|
Très rares : |
Érythème polymorphe, syndrome de Stevens-Johnson, nécrolyse épidermique toxique (NET) |
|
Fréquence indéterminée : |
Lupus érythémateux cutané subaigu (voir section 4.4) |
|
Affections musculosquelettiques et systémiques |
|
|
Peu fréquents : |
Fracture de la hanche, du poignet ou fracture vertébrale |
|
Rares : |
Arthralgie, myalgie |
|
Très rares : |
Faiblesse musculaire |
|
Affections du rein et des voies urinaires |
|
|
Rares : |
Néphrite interstitielle |
|
Affections des organes de reproduction et du sein |
|
|
Très rares : |
Gynécomastie |
|
Troubles généraux et anomalies au site d'administration |
|
|
Peu fréquents : |
Malaise, œdème périphérique |
|
Rares : |
Augmentation de la sudation |
Population pédiatrique
La sécurité de l’oméprazole a été évaluée sur un total de 310 enfants entre 0 et 16 ans souffrant d’une maladie liée à l’acidité gastrique. Les données de sécurité sur l’usage à long terme sont limitées et proviennent de 46 enfants ayant reçu un traitement d’entretien par oméprazole au cours d’une étude clinique pour les œsophagites érosives graves allant jusqu’à 749 jours. Le profil des effets indésirables était généralement le même que pour les adultes, aussi bien pour les traitements de courte durée que de longue durée. Il n’existe pas de données sur le long terme en ce qui concerne les effets d’un traitement par oméprazole sur la puberté et la croissance.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Les symptômes décrits ont été passagers et aucune conséquence grave n’a été reportée. Le taux d’élimination est resté inchangé (cinétique de premier ordre) avec des doses augmentées. Le traitement, si besoin, est symptomatique.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Médicament pour les troubles liés à l’acidité, inhibiteurs de la pompe à protons, code ATC : A02BC01.
Mécanisme d’action
L’oméprazole est un mélange racémique de deux énantiomères réduisant la sécrétion d’acide gastrique via un mécanisme d’action spécifiquement ciblé. Il s’agit d’un inhibiteur spécifique de la pompe d’acide dans la cellule pariétale. Il agit rapidement et fournit un contrôle à travers l’inhibition réversible de la sécrétion d’acide gastrique avec une dose unique journalière.
L’oméprazole est une base faible. Il est concentré et converti en forme active au sein de l’environnement hautement acidique des canalicules intracellulaires des cellules pariétales, où il inhibe l’enzyme H+ K+- ATPase (la pompe à protons). Cette étape finale du processus de formation de l’’acidité gastrique est dépendante de la dose et entraîne une inhibition importante de la sécrétion d’acide basale et de la sécrétion acide stimulée, quel que soit le stimulus.
Effets pharmacodynamiques
Tous les effets pharmacodynamiques observés peuvent être expliqués par l’effet de l’oméprazole sur la sécrétion d’acide.
Effet sur la sécrétion d’acide gastrique
La prise orale unique quotidienne d’oméprazole permet une inhibition rapide et efficace de la sécrétion d’acide gastrique pendant la journée et la nuit, avec un maximum d’effet obtenu dans les 4 jours de traitement. Avec 20 mg d’oméprazole, une réduction moyenne d’au moins 80 % en 24 heures de l’acidité intragastrique est alors maintenue chez les patients souffrant d’ulcère duodénal, avec la réduction moyenne du résultat du pic d’acide après une stimulation de pentagastrine d’environ 70 % 24 heures après la prise.
Une prise orale de 20 mg d’oméprazole maintient un pH intragastrique de supérieur ou égal à 3 pour une durée moyenne de 17 heures sur une période de 24 heures chez des patients souffrant d’ulcère duodénal.
En conséquence de la réduction de sécrétion d’acide et d’acidité intragastrique, l’oméprazole réduit/normalise selon la dose l’exposition de l’œsophage à l’acide, chez les patients souffrant de reflux gastro-œsophagien.
L’inhibition de la sécrétion d’acide est liée à l’aire sous la courbe (ASC) de la concentration par heure d’oméprazole et non à la concentration plasmatique exacte à un temps donné.
Aucune tachyphylaxie n’a été observée lors du traitement à l’oméprazole.
Effet sur H. pylori
H. pylori est associé à la maladie ulcéreuse gastroduodénale incluant l’ulcère gastrique et l’ulcère duodénal. H. pylori est un facteur important dans le développement de la gastrite. H. pylori et l’acide gastrique sont des facteurs importants dans le développement de la maladie ulcéreuse gastroduodénale. H. pylori est un facteur important dans le développement de la gastrite atrophique associé à une augmentation du risque de développer un cancer gastrique.
L’éradication de H. pylori par l’oméprazole associé à des antimicrobiens est associée à des taux élevés de cicatrisation et de rémission à long terme des ulcères gastroduodénaux.
Les bithérapies ont été testées et se sont révélées moins efficaces que les trithérapies. Les bithérapies peuvent cependant être envisagées lors d’une hypersensibilité connue empêchant l’utilisation des trithérapies.
Autres effets liés à l’inhibition de l’acide
Lors d’un traitement à long terme, des kystes glandulaires gastriques ont été observés avec une fréquence légèrement augmentée. Ces modifications sont une conséquence physiologique d’une inhibition prononcée de la sécrétion acide : elles sont bénignes et réversibles.
La diminution de l'acidité gastrique, quelle qu’en soit l’origine y compris l’utilisation des inhibiteurs de la pompe à protons, favorise le développement de bactéries intra-gastriques normalement présentes dans le tractus gastro-intestinal. Un traitement entraînant la diminution de l’acidité peut conduire à un risque légèrement augmenté d’infections gastro-intestinales, telles que les infections par Salmonella et Campylobacter et possiblement par Clostridium difficile chez les patients hospitalisés.
Pendant le traitement par des médicaments antisécrétoires, la concentration sérique de gastrine augmente en réaction à la diminution de la sécrétion acide. De même, le taux de CgA augmente à cause de la diminution de l’acidité gastrique. L’augmentation du taux de CgA peut interférer avec les tests réalisés pour l’exploration des tumeurs neuroendocrines.
D’après des données publiées, la prise d’inhibiteurs de la pompe à protons devrait être interrompue entre 5 jours et 2 semaines avant de mesurer le taux de CgA. Le but est de permettre un retour à la normale des taux de CgA qui auraient été artificiellement augmentés par la prise d’IPP.
Une augmentation du nombre de cellules ECL en relation possible avec l’augmentation des concentrations sériques de la gastrine a été observée chez certains patients (à la fois des adultes et des enfants) traités au long cours avec l’oméprazole. Les résultats sont considérés comme étant non cliniquement significatifs.
Population pédiatrique
Dans une étude non contrôlée menée chez des enfants (1 à 16 ans) atteints d’œsophagite sévère par reflux, l’oméprazole, à des doses comprises entre 0,7 et 1,4 mg/kg, a amélioré le stade de l’œsophagite dans 90 % des cas et a diminué de manière significative les symptômes de reflux. Au cours d’une étude en simple aveugle, des enfants âgés de 0 à 24 mois ayant fait l’objet d’un diagnostic clinique de reflux gastro-œsophagien ont été traités avec 0,5 mg, 1 mg ou 1,5 mg d’oméprazole/kg. La fréquence des épisodes de vomissements/régurgitation a diminué de 50 % après 8 semaines de traitement quelle que soit la dose.
Éradication de H. pylori chez les enfants
Une étude clinique en double aveugle randomisée (étude Héliot) a conclu à l’efficacité et à la bonne tolérance de l’oméprazole associé à deux antibiotiques (amoxicilline et clarithromycine) dans le traitement des infections à H. pylori chez les enfants âgés de 4 ans et plus souffrant de gastrite : taux d’éradication de H. pylori : 74,2 % (23/31 patients) avec oméprazole + amoxicilline + clarithromycine versus 9,4 % (3/32 patients) avec amoxicilline + clarithromycine. Néanmoins, aucune preuve n’a été apportée quant au bénéfice clinique sur les symptômes dyspeptiques. Cette étude n’apporte aucune information concernant les enfants de moins de 4 ans.
5.2. Propriétés pharmacocinétiques
L’oméprazole est un acide labile et est par conséquent apporté dans NEXOCET 4 mg/mL, poudre pour suspension buvable sous forme de suspension tamponnée. Le tampon protège l’oméprazole de la dégradation de l’acide, ce qui facilite l’absorption. L’absorption de l’oméprazole est rapide, avec un pic plasmatique qui apparait environ 30 minutes après la dose. L’absorption de l’oméprazole a lieu dans l’intestin grêle et est complète généralement dans les 3 à 6 heures. Dans une étude sur la biodisponibilité, l’administration avec de la nourriture (lait) a réduit l’étendue de l’absorption d’environ 20 %. La disponibilité systémique (biodisponibilité) pour une dose orale simple d’oméprazole est d’environ 40 %. Après une administration de dose unique quotidienne répétée, la biodisponibilité augmente d’environ 60 %.
Distribution
Le volume apparent de la distribution chez les sujets sains est environ 0,3 L/kg de masse corporelle. La liaison de l’oméprazole aux protéines plasmatiques est de 97 %.
Biotransformation
L’oméprazole est totalement métabolisé par le cytochrome P450 (CYP). La majeure partie de son métabolisme est dépendante du polymorphisme de l’enzyme CYP2C19, responsable de la formation de l’hydroxy-oméprazole, principal métabolite plasmatique. La partie restante est dépendante d’une autre isoforme spécifique, le CYP3A4, responsable de la formation de sulfone d’oméprazole. Du fait de la forte affinité de l’oméprazole pour le CYP2C19, il existe potentiellement une inhibition compétitive et des interactions médicamenteuses métaboliques avec d’autres substrats du CYP2C19.
En revanche, l’oméprazole n’a pas le potentiel d’inhiber le métabolisme d’autres substrats du CYP3A4 du fait de sa faible affinité pour le CYP3A4. De plus, l’oméprazole n’a pas d’effet inhibiteur sur les principales enzymes CYP.
Environ 3% de la population caucasienne et 15-20% de la population asiatique possèdent une enzyme CYP2C19 peu fonctionnelle et sont appelés métaboliseurs lents. Chez ces individus, le métabolisme de l’oméprazole est probablement principalement réalisé par le CYP3A4. Après des administrations répétées de doses journalières de 20 mg d’oméprazole, l’aire sous la courbe (ASC) moyenne a été de 5 à 10 fois supérieure chez les métaboliseurs lents que chez les sujets ayant une enzyme CYP2C19 fonctionnelle (métaboliseurs rapides). Les pics de concentrations plasmatiques moyens étaient également de 3 à 5 fois plus élevés. Ceci n’a pas d’implication sur la posologie quotidienne de l’oméprazole.
Élimination
La demi-vie de l’élimination plasmatique de l’oméprazole est généralement de moins d’une heure après une prise unique quotidienne simple et répétée. L’oméprazole est complètement éliminé du plasma entre les doses, sans aucune tendance à l’accumulation lors de la prise unique quotidienne. Près de 80% d’une dose orale d’oméprazole est excrété en tant que métabolites dans l’urine, le reste dans les matières fécales, trouvant principalement leur origine dans la sécrétion biliaire.
Linéarité/non-linéarité
L’aire sous courbe de l’oméprazole augmente avec une administration répétée. Cette augmentation dépend du dosage et conduit à une relation dose-aire sous la courbe non-linéaire après une administration répétée. Cet effet temps- et dose-dépendant est dû à une réduction de métabolisme de premier passage et de clairance systémique, probablement causée par une inhibition de l’enzyme CYP2C19 due à l’oméprazole et/ou ses métabolites (par ex. la sulfone).
On n’a trouvé aucun métabolite ayant un effet sur la sécrétion gastrique.
Populations spéciales
Insuffisance hépatique
Le métabolisme de l’oméprazole chez les patients souffrant de dysfonction hépatique est insuffisant, ce qui donne une aire sous la courbe augmentée. L’oméprazole n’a démontré aucune tendance à l’accumulation avec les doses uniques quotidiennes.
Insuffisance rénale
La pharmacocinétique de l’oméprazole, dont la biodisponibilité systémique et le taux d’élimination, demeurent inchangés chez les patients aux fonctions rénales réduites.
Les personnes âgées
Le taux de métabolisme de l’oméprazole est assez soutenu chez les sujets âgés (entre 75 et 79 ans).
Population pédiatrique
Lors du traitement avec les doses recommandées chez les enfants à partir de 1 an, des concentrations en plasma similaires ont été obtenues par rapport aux adultes. Chez les enfants de moins de 6 mois, la clairance de l’oméprazole est faible, à cause d’une faible capacité à métaboliser l’oméprazole.
5.3. Données de sécurité préclinique
Des observations similaires ont été faites après traitement avec des antagonistes du récepteur H2, des inhibiteurs de la pompe à protons, et après fundectomie partielle. De ce fait, ces changements ne résultent pas d’un effet direct d’une quelconque substance active individuelle.
Bicarbonate de potassium (E501)
Alginate de sodium (E401)
Maltitol (E965)
Mannitol (E421)
Sucralose (E955)
Gomme xanthane (E415)
Arôme naturel de menthe contenant de la gomme arabique / gomme acacia (E414) et pulegone
Dioxyde de titane (E171)
Benzoate de sodium (E211)
Parahydroxybenzoate de méthyl sodique (E219)
Suspension reconstituée : 28 jours.
La suspension reconstituée doit être conservée au réfrigérateur (entre 2° et 8°C). Conserver dans son emballage d’origine, à l’abri de la lumière. Garder le flacon hermétiquement fermé. Elle peut être conservée pendant 2 jours maximum à une température ne dépassant pas 25°C.
6.4. Précautions particulières de conservation
Poudres sèches : A conserver à une température ne dépassant pas 25°C. Conserver dans son emballage d’origine, à l’abri de la lumière et de l’humidité.
Pour les conditions de conservation après reconstitution du produit, voir rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
Bouteille en plastique ambre (PET) contenant la poudre, dotée d’un capuchon de fermeture en polypropylène rouge (PP) contenant de la poudre, le tout emballé dans une poche en feuille d’aluminium.
Chaque flacon contient 47 g de poudre pour suspension buvable. Une fois la suspension reconstituée, le flacon contient 90 mL de suspension buvable dont 75 mL servent au dosage et à l’administration.
Boîte : 1 ou 2 flacons.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Il est recommandé qu’un pharmacien reconstitue NEXOCET 4 mg/mL poudre pour suspension buvable avant de la donner au patient.
Préparation et prise de la suspension
Le récipient est un système à deux compartiments contenant de la poudre à la fois dans le bouchon et dans le flacon. Les deux poudres doivent d’abord être mélangées pour ensuite préparer la suspension avec de l’eau. Un disque de mélange rouge va tomber dans la suspension médicamenteuse pour aider à mélanger les poudres ainsi que la suspension reconstituée après l’ajout de l’eau. Il devra rester dans le flacon. Le capuchon rouge est remplacé par un capuchon gris après la reconstitution.
Instructions pour la préparation initiale.
Combinaison de poudre dans le capuchon et le flacon
· Secouer le flacon pendant 10 secondes pour fluidifier la poudre.
· Tourner le capuchon rouge dans le sens anti-horaire (voir la flèche sur le capuchon) jusqu’à ce que le sceau casse pour relâcher la poudre du capuchon rouge dans le flacon.
· Tourner le capuchon rouge dans sa position initiale, bien le refermer sur la bouteille.
Préparation de la poudre
· Secouer vigoureusement la bouteille pendant dix secondes pour mélanger les poudres.
· Taper le fond du flacon trois fois contre une surface plane dure afin de s’assurer que toute la poudre soit dans le flacon et non dans le capuchon.
· Retirer le capuchon rouge du flacon.
· Ajouter 64 mL d’eau en utilisant un instrument de mesure approprié jusqu’à la ligne indiquée sur l’étiquette.
· Bien refermer le capuchon rouge sur le flacon et secouer vigoureusement pendant 30 secondes.
Disposition de l’adaptateur de la seringue
· Retirer le capuchon rouge et l’anneau rouge ; mettre de côté.
· Insérer l’adaptateur de flacon incolore et transparent et remplacer le capuchon rouge par le bouchon à vis en plastique gris.
· Laisser reposer quinze minutes pour que le produit atteigne sa consistance finale.
Mesurer votre dose
Instructions pour l’utilisation de la seringue
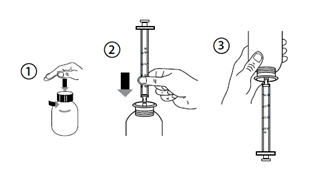
1. Secouer pendant 20 secondes juste avant chaque utilisation
2. Pour ouvrir le flacon, appuyer sur le bouchon gris et le tourner dans les sens anti-horaire (Figure 1). Ne pas retirer la portion blanche du bouchon.
3. Prendre la seringue et la placer dans l’ouverture de l’adaptateur (Figure 2).
4. Tourner le flacon à l’envers (Figure 3).
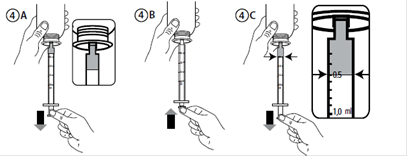
5. Remplir la seringue avec une petite quantité de suspension en tirant le piston vers le bas (Figure 4A). Pousser ensuite le piston vers le haut afin d’éliminer des bulles éventuelles (Figure 4B). Enfin, tirer le piston jusqu’à la graduation correspondant à la quantité en millilitres (mL) prescrite par votre médecin. Le bord plat supérieur du piston doit être aligné avec la marque de graduation que vous utilisez (Figure 4C).
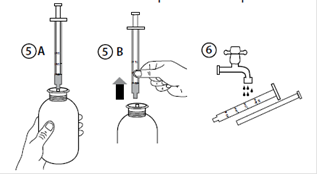
6. Retourner la bouteille à l’endroit (Figure 5A).
7. Retirer la seringue de l’adaptateur (Figure 5B).
8. Placer le bout de la seringue dans la bouche du patient et pousser lentement le piston pour prendre le médicament. La suspension sera déversée lentement, mais la dernière portion sera déversée plus rapidement à cause d’une résistance réduite dans la pointe de la seringue.
9. Laver la seringue à l’eau et laisser sécher avant une nouvelle utilisation (Figure 6).
10. Refermer le flacon avec le bouchon à vis en plastique gris - laisser l’adaptateur de la bouteille dans le flacon.
Note : Il est normal que le disque en plastique rouge reste dans la suspension lors de l’utilisation ; n’essayez pas de le retirer.

Instructions concernant l’administration par une sonde nasogastrique (NG) ou une gastrostomie endoscopique percutanée (PEG) :
Assurez-vous que la sonde d'alimentation entérale n'est pas obstruée avant l'administration.
1. Purger le tube entéral avec 5 mL d'eau.
2. Administrer la dose requise de suspension buvable d'oméprazole à l'aide d'un appareil de mesure approprié.
3. Purger le tube entéral avec 5 mL d'eau.
Ce produit peut être utilisé avec des tubes nasogastriques (NG) en polyuréthane et PVC et des tubes de gastrostomie endoscopique percutanée (PEG) de taille 6 Fr à 16 Fr. Pour le plus petit diamètre de tube (6 Fr), un plus petit débit de 2 mL peut être utilisé pour les très jeunes enfants, chez qui les restrictions de consommation de liquides peuvent être pertinentes.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
XEOLAS PHARMACEUTICALS LIMITED
HAMILTON BUILDING
DCU, GLASNEVIN
DUBLIN 9
IRLANDE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 304 3 5 : Poudre en flacon (PET) avec seringue pour administration orale graduée (PP) ; boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste II