RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 24/07/2023
COFACT 25 UI/mL de facteur IX, poudre et solvant pour solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
|
|
COFACT 250 UI (facteur IX) |
COFACT 500 UI (facteur IX) |
Après reconstitution* (UI/mL) |
|
|
|
|
|
|
Facteur II de coagulation |
140 - 350 |
280 - 700 |
14 - 35 |
|
Facteur VII de coagulation |
70 - 200 |
140 - 400 |
7 - 20 |
|
Facteur IX de coagulation |
250 |
500 |
25 |
|
Facteur X de coagulation |
140 - 350 |
280 - 700 |
14 - 35 |
|
Autres substances actives |
|
|
|
|
Protéine C |
111 - 390 |
222 - 780 |
11 - 39 |
|
Protéine S |
10 - 80 |
20 - 160 |
1 - 8 |
|
*Après reconstitution avec 10 mL (pour COFACT 250 UI) ou 20 mL (pour COFACT 500 UI) d’eau pour préparations injectables. |
|||
La quantité totale de protéines par flacon est de 130 – 350 mg (COFACT 250 UI) ou de 260 – 700 mg (COFACT 500 UI). L’activité spécifique du produit est ≥ 0,6 UI/mg, exprimée en tant qu’activité du facteur IX.
Les activités de tous les facteurs de coagulation ainsi que des protéines C et S (antigène) ont été testées conformément aux normes en vigueur de l’OMS ou de la Pharmacopée européenne.
Après reconstitution, ce médicament contient 125 – 195 mmol de sodium/L, jusqu’à 44,8 mg de sodium par 10 mL.
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre et solvant pour solution injectable.
La poudre est de couleur bleuâtre. Le solvant est une solution transparente, incolore, exempte de particules visibles.
4.1. Indications thérapeutiques
Traitement des saignements et prophylaxie péri-opératoire des accidents hémorragiques lors d'un déficit congénital de l'un des facteurs vitamine K dépendants, lorsque aucun facteur de coagulation spécifique de haute pureté n'est disponible.
4.2. Posologie et mode d'administration
Les posologies recommandées ci-dessous sont données à titre indicatif. Le traitement doit être initié sous la surveillance d'un médecin spécialiste des troubles de la coagulation. La posologie et la durée du traitement de substitution dépendent de la sévérité du trouble, de la localisation et de l'intensité de l'accident hémorragique, ainsi que de l'état clinique du patient.
La dose et la fréquence d'administration doivent être calculées sur la base de chaque cas individuel. L'intervalle entre les administrations doit être adapté en fonction des demi-vies des différents facteurs de coagulation du complexe prothrombique (voir section 5.2).
La posologie individuelle peut uniquement être déterminée sur la base des évaluations régulières des taux plasmatiques du facteur de coagulation à corriger ou sur la base d'un test global évaluant le taux de complexe prothrombique (temps de prothrombine, INR), et en fonction du suivi continu de l'état clinique du patient.
Dans le cas d'interventions chirurgicales majeures, il est important de réaliser un suivi précis du traitement de substitution à l'aide de tests de coagulation (tests spécifiques évaluant les facteurs de coagulation et/ou test global évaluant le taux de complexe prothrombique).
Traitement des saignements et prophylaxie péri-opératoire des accidents hémorragiques lors d'un traitement par anti-vitamines K :
La dose dépendra de l'INR avant traitement, de l'INR cible et du poids corporel. Les tableaux suivants indiquent les doses approximatives requises dans le cadre de la correction de l'INR pour des niveaux d'INR initiaux différents.
Les tableaux de posologie constituent uniquement des recommandations d'ordre général en matière de posologie et ne sauraient en aucun cas remplacer l'évaluation individuelle de la posologie adaptée à chaque patient ni la surveillance étroite de l'INR et autres paramètres de la coagulation pendant le traitement.
Doses recommandées de COFACT en mL pour obtenir un INR cible ≤ 2,1
|
INR initial Poids |
7,5 |
5,9 |
4,8 |
4,2 |
3,6 |
3,3 |
3,0 |
2,8 |
2,6 |
2,5 |
2,3 |
2,2 |
|
50 kg. |
40 |
40 |
40 |
30 |
30 |
30 |
20 |
20 |
X |
X |
X |
X |
|
60 kg. |
50 |
50 |
40 |
40 |
30 |
30 |
30 |
20 |
X |
X |
X |
X |
|
70 kg. |
60 |
50 |
50 |
50 |
40 |
40 |
30 |
30 |
X |
X |
X |
X |
|
80 kg. |
60 |
60 |
60 |
50 |
50 |
40 |
40 |
30 |
X |
X |
X |
X |
|
90 kg. |
60 |
60 |
60 |
60 |
50 |
50 |
40 |
30 |
X |
X |
X |
X |
|
100 kg. |
60 |
60 |
60 |
60 |
60 |
50 |
40 |
40 |
X |
X |
X |
X |
Doses recommandées de COFACT en mL pour obtenir un INR cible ≤ 1,5
|
INR initial Poids |
7,5 |
5,9 |
4,8 |
4,2 |
3,6 |
3,3 |
3,0 |
2,8 |
2,6 |
2,5 |
2,3 |
2,2 |
|
50 kg. |
60 |
60 |
60 |
50 |
50 |
50 |
40 |
40 |
30 |
30 |
30 |
30 |
|
60 kg. |
80 |
70 |
70 |
60 |
60 |
60 |
50 |
50 |
40 |
40 |
40 |
30 |
|
70 kg. |
90 |
80 |
80 |
70 |
70 |
70 |
60 |
60 |
50 |
40 |
40 |
40 |
|
80 kg. |
100 |
100 |
90 |
90 |
90 |
80 |
80 |
70 |
60 |
50 |
50 |
40 |
|
90 kg. |
100 |
100 |
100 |
90 |
90 |
90 |
80 |
80 |
70 |
60 |
50 |
40 |
|
100 kg. |
100 |
100 |
100 |
100 |
100 |
90 |
90 |
80 |
70 |
70 |
60 |
50 |
Les doses sont calculées sur la base de la concentration de facteur IX dansCOFACT, en raison de sa demi-vie relativement courte et de son faible rendement après perfusion comparativement aux autres facteurs de coagulation présents dans le concentré de complexe prothrombique.
Il est admis qu’une concentration plasmatique moyenne de facteur IX ³ 30 % suffit pour obtenir un INR £ 2,1 et ³ 60 % pour obtenir un INR £ 1,5. Les quantités calculées sont arrondies au multiple de 10 mL le plus proche, avec une limite supérieure fixée à 60 ou 100 mL au total (voir tableaux ci-dessus). Les valeurs d’INR cible sont recommandées par la Fédération des services néerlandais de traitement de la thrombose et sont semblables aux recommandations britanniques et allemandes.
La correction de la diminution de l'hémostase induite par les anti-vitamines K dure environ 6 à 8 heures. Toutefois, les effets de la vitamine K, si elle est administrée simultanément, sont habituellement obtenus en 4 à 6 heures. Aussi, un traitement répété par le complexe prothrombique humain n'est généralement pas nécessaire lorsque la vitamine K est administrée.
Comme ces recommandations sont empiriques et que le taux de récupération et la durée de l'effet peuvent varier, le suivi de l'INR durant le traitement est obligatoire.
Traitement des saignements et prophylaxie péri-opératoire lors de déficit congénital de l'un des facteurs vitamine K dépendants, lorsqu'aucun facteur de coagulation spécifique n’est pas disponible :
Le calcul de la dose nécessaire pour le traitement repose sur les notions empiriques que approximativement 1 UI de facteur VII ou de facteur IX par kg de poids corporel élève l'activité plasmatique du facteur VII ou IX de 0,01 UI/mL et 1 UI de facteur II ou de facteur X par kg de poids corporel élève l'activité plasmatique du facteur II ou X de 0,02 et 0,017 UI/mL, respectivement.
La posologie d'un facteur spécifique administré est exprimée en Unités internationales (UI) par rapport au standard de l'OMS en vigueur pour chaque facteur. L'activité plasmatique d'un facteur de coagulation spécifique est exprimée soit en pourcentage (de l'activité normale du plasma humain) ou soit en Unités internationales (par rapport à l'étalon international pour le facteur de coagulation spécifique).
Une Unité Internationale (UI) de l'activité d'un facteur de coagulation correspond à la quantité de ce facteur contenue dans un mL de plasma humain normal.
Par exemple, la détermination de la posologie requise en facteur X est basée sur la notion empirique que 1 Unité Internationale (UI) de facteur X par kg de poids corporel augmente l'activité plasmatique de facteur X de 0,017 UI/mL. La dose requise est déterminée en utilisant la formule suivante :
Nombre d’unités requises = poids corporel (kg) x augmentation de facteur X souhaitée (UI/mL) x 60
Où 60 (mL/kg) correspond à l’inverse de la récupération estimée.
Si la récupération individuelle est connue, cette valeur doit être utilisée pour le calcul.
Population pédiatrique
La sécurité et l’efficacité de COFACT chez les patients pédiatriques n’ont pas été établies.
Mode d’administration
Pour les instructions concernant la reconstitution du médicament avant administration, voir la rubrique 6.6. Il convient d'administrer COFACT par voie intraveineuse.
Il est recommandé d'administrer le produit reconstitué à un débit d'environ 2 mL par minute.
Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi
Afin d’améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Il est recommandé de demander l'avis d'un spécialiste expérimenté dans la prise en charge des troubles de la coagulation.
Il convient de n’administrer COFACT aux patients atteints d’un déficit acquis en facteurs de coagulation vitamine K dépendants (par exemple, induit par un traitement par antagonistes de la vitamine K) qu'en cas de nécessité de corriger rapidement le taux du complexe prothrombique, comme en cas d'hémorragie majeure ou d’intervention chirurgicale urgente.
Dans d'autres cas, une réduction de la dose de l'antagoniste de la vitamine K et/ou l'administration de vitamine K est habituellement suffisante.
Les patients recevant des antagonistes de la vitamine K peuvent se trouver dans un état d'hypercoagulabilité sous-jacente et la perfusion de complexe prothrombique humain est susceptible d'exacerber cet état.
Il convient d'utiliser un produit du facteur de coagulation spécifique, sous réserve de sa disponibilité, dans les cas de déficit congénital en l'un des facteurs vitamine K dépendants.
En cas de réaction allergique ou de type anaphylactique, l'injection/perfusion doit être immédiatement interrompue. En cas d'état de choc, il convient de mettre en œuvre un traitement médical standard de l'état de choc.
Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments préparés à partir de sang ou de plasma humain comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les mélanges de plasma ainsi que la mise en œuvre dans le procédé de fabrication d'étapes pour l'inactivation/élimination virale. Cependant, lorsque des médicaments préparés à partir de sang ou de plasma humain sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents ou autres types d'agents infectieux.
Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le virus de l’immunodéficience humaine (VIH), le virus de l’hépatite B (VHB), le virus de l’hépatite C (VHC) et du virus non enveloppé de l’hépatite A (VHA). Les mesures prises peuvent avoir une efficacité limitée vis-à-vis d’autres virus non enveloppés tels que le parvovirus B19. Une infection par le parvovirus B19 peut être grave pour les femmes enceintes (infection fœtale) et les personnes immunodéficientes ou présentant une hausse de l’érythropoïèse (par exemple, une anémie hémolytique).
Il convient d’envisager une vaccination appropriée (hépatites A et B) des patients recevant de manière régulière/répétée des concentrés de complexe prothrombique dérivés du plasma humain.
Il existe un risque de thrombose ou de coagulation intravasculaire disséminée lorsque les patients présentant un déficit congénital ou acquis sont traités par le complexe prothrombique humain, particulièrement en cas d'administrations répétées. Ce risque est plus important dans le cas du traitement d'un déficit isolé en facteur VII, puisque les autres facteurs de coagulation vitamine K dépendants, présentant des demi-vies plus longues, peuvent atteindre des taux beaucoup plus élevés que la normale.
Les patients traités par un complexe prothrombique humain doivent être surveillés étroitement pour détecter les signes ou symptômes évocateurs d'une coagulation intravasculaire disséminée ou d'une thrombose. En raison de ce risque de complications thromboemboliques, un suivi étroit doit être réalisé lorsque un complexe prothrombique humain est administré aux patients présentant des antécédents de maladie coronarienne, aux patients atteints de maladie hépatique, aux patients en période péri- et post-opératoire, aux nouveau-nés, ou aux patients présentant un risque de manifestations thromboemboliques ou de coagulation intravasculaire disséminée. Dans chacune de ces situations, le bénéfice potentiel du traitement doit être évalué par rapport aux risques de ces complications.
Aucune information n'est disponible sur l'utilisation de COFACT en cas d'hémorragie périnatale due à un déficit en vitamine K du nouveau-né.
Excipients
COFACT contient jusqu’à 448 mg de sodium par 100 mL, ce qui équivaut à un maximum de 22 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte. A prendre en compte pour les patients suivant un régime à faible teneur en sodium.
Population pédiatrique
Il existe trop peu de données disponibles pour recommander l’administration de COFACT chez les enfants et les adolescents.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Le complexe prothrombique humain neutralise les effets d'un traitement par anti-vitamines K, mais aucune interaction avec d'autres spécialités pharmaceutiques n'est connue.
4.6. Fertilité, grossesse et allaitement
La sécurité du complexe prothrombique humain lors de l'utilisation chez la femme enceinte et lors de l'allaitement n'a pas été établie.
Les études chez l'animal ne permettent pas d'établir la sécurité pendant la grossesse, le développement embryo- fœtal, l'accouchement ou le développement post-natal. Aussi, le complexe prothrombique humain ne doit être utilisé qu'en cas d'indication absolue au cours de la grossesse et de l'allaitement Consultez la rubrique 4.4 pour des informations relatives au risque d’infection par le parvovirus B19 chez la femme enceinte.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
Tableau récapitulatif des effets indésirables de COFACT.
Les effets indésirables présentés ont été au cours des études cliniques et lors de l'utilisation post-commercialisation de COFACT. Le tableau présenté ci-dessous est établi conformément à la classification des systèmes d’organes MedDRA (CSO et termes préconisés). La fréquence des effets indésirables est définie selon la convention suivante : très fréquent (≥ 1/10) ; fréquent (≥ 1/100, < 1/10) ; peu fréquent (≥ 1/1 000, < 1/100) ; rare (≥ 1/10 000, < 1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés par ordre décroissant de gravité.
Fréquence des effets indésirables
|
Classe de systèmes d’organes MedDRA (CSO) |
Effet indésirable |
Fréquence |
|
Affections du système immunitaire |
Réaction anaphylactique, hypersensibilité |
Fréquence indéterminée |
|
Affections du système nerveux |
Accident vasculaire cérébral, étourdissement |
Fréquence indéterminée |
|
Affections cardiaques |
Infarctus aigu du myocarde |
Fréquence indéterminée |
|
Affections vasculaires |
Événements thromboemboliques (embolie, thrombose veineuse profonde) ; voir rubrique 4.4 |
Fréquent |
|
Hypotension |
Peu fréquent |
|
|
Affections respiratoires, thoraciques et médiastinales |
Embolie pulmonaire, insuffisance respiratoire |
Fréquence indéterminée |
|
Affections gastro-intestinales |
Nausées, vomissements |
Fréquence indéterminée |
|
Affections de la peau et du tissu sous-cutané |
Hyperhidrose, prurit, urticaire |
Fréquence indéterminée |
|
Troubles généraux et anomalies au site d'administration |
Rougeur au niveau du site de perfusion, irritation au niveau du site de perfusion, tuméfaction au niveau du site de perfusion Malaise |
Fréquence indéterminée |
|
Investigations |
Anomalies de la fonction hépatique |
Fréquence indéterminée |
Le traitement de substitution provoque la formation d'anticorps circulants inhibant l'un ou plusieurs facteurs du complexe prothrombique humain. La présence de tels inhibiteurs se traduit par une mauvaise réponse clinique, par exemple, des saignements persistants.
Pour de plus amples informations sur les dangers liés aux agents transmissibles, voir rubrique 4.4.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
L'utilisation de doses élevées de complexe prothrombique humain a été associée à des cas d'infarctus du myocarde, de coagulation intravasculaire disséminée, de thrombose veineuse et d'embolie pulmonaire. Aussi, en cas de surdosage, le risque de développement de complications thromboemboliques ou de coagulation intravasculaire disséminée est augmenté.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antihémorragiques, facteurs de coagulation IX, II, VII et X en association, code ATC : B02BD01.
Les facteurs de coagulation II, VII, IX et X, qui sont synthétisés dans le foie à l'aide de la vitamine K, forment le complexe prothrombique. En plus des facteurs de coagulation, COFACT contient les protéines C et S vitamine K dépendantes et inhibitrices de la coagulation.
Le facteur VII est le zymogène du facteur VIIa (sérine protéase active) par lequel la voie extrinsèque de la coagulation est activée. Le complexe facteur tissulaire-facteur VIIa active les facteurs IX et X, entraînant la formation des facteurs IXa et Xa. Lors de la suite de l'activation de la cascade de la coagulation, la prothrombine (facteur II) est activée et transformée en thrombine. Sous l'action de la thrombine, le fibrinogène est converti en fibrine, ce qui aboutit à la formation du caillot. La formation normale de thrombine est aussi essentielle à la fonction plaquettaire dans l'hémostase primaire.
Un déficit sévère et isolé en facteur VII se traduit par une baisse de la formation de thrombine et une tendance aux hémorragies, à la suite d'un déficit de formation de la fibrine et une diminution de l'hémostase primaire. Un déficit isolé en facteur IX est une des hémophilies classiques (hémophilie B).
Les déficits isolés en facteur II ou X sont très rares mais les formes sévères se traduisent par des hémorragies similaires à celles observées dans l'hémophilie classique.
Les autres substances, les protéines C et S inhibitrices de la coagulation, sont également synthétisées par le foie. L’activité biologique de la protéine C est renforcée par la protéine S, qui est son cofacteur.
La protéine C activée inhibe la coagulation en inactivant les facteurs Va et VIIIa. La protéine S, à titre de cofacteur de la protéine C, renforce l’inactivation de la coagulation. Un déficit en protéine C est associé à un accroissement du risque de thrombose.
Les déficits acquis en facteurs de coagulation vitamine K dépendants surviennent lors de traitement par les anti- vitamines K. Quand le déficit devient sévère, une forte tendance hémorragique se développe, caractérisée par des saignements rétro-péritonéaux ou cérébraux, plutôt que des hémorragies musculaires et articulaires. Une insuffisance hépatique sévère peut également provoquer une baisse marquée des facteurs de la coagulation vitamine K dépendants, ainsi qu'un tableau clinique hémorragique qui est souvent complexe, du à la fois à une coagulation intravasculaire continue, des taux de plaquettes réduits, un déficit en inhibiteurs de la coagulation et une fibrinolyse perturbée.
L'administration de complexe prothrombique humain augmente le taux plasmatique des facteurs de coagulation vitamine K dépendants et peut corriger temporairement le défaut de coagulation chez les patients présentant un déficit d'un ou plusieurs de ces facteurs.
5.2. Propriétés pharmacocinétiques
|
Facteur de coagulation |
Demi-vie |
|
Facteur II |
40 - 60 heures |
|
Facteur VII |
4 - 6 heures |
|
Facteur IX |
18 - 25 heures |
|
Facteur X |
30 - 60 heures |
5.3. Données de sécurité préclinique
Des études toxicologiques ont été réalisées sur des animaux de laboratoire avec le TNBP et le Tween 80. COFACT contient au plus 0,4 µg de TNBP par UI de facteur IX et au plus 4 µg de Tween 80 par UI de facteur IX. Lorsque COFACT est administré aux doses recommandées, les quantités de TNBP et de Tween 80 reçues par un patient demeurent largement inférieures aux niveaux qui se sont avérés dangereux lors des expériences menées sur des animaux de laboratoire.
Poudre : citrate de sodium, chlorure de sodium, antithrombine ≤ 0,6 UI/mL.
Solvant : eau pour préparations injectables.
Ce médicament ne doit pas être mélangé avec d’autres médicaments.
COFACT est compatible avec les matériels en polypropylène. Un échec du traitement peut se produire suite à l’adsorption des facteurs de coagulation à la surface interne d’autres matériels d’injection/perfusion.
3 ans.
Après reconstitution, la stabilité physico-chimique en cours d’utilisation a été démontrée pendant 3 heures à une température entre 15 °C et 25 °C. D’un point de vue microbiologique, le produit doit être utilisé immédiatement après reconstitution. En cas d’utilisation non immédiate, les durées et conditions de conservation en cours d’utilisation et avant utilisation relèvent de la responsabilité de l’utilisateur.
6.4. Précautions particulières de conservation
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler. Conserver le flacon dans l'emballage extérieur, à l’abri de la lumière.
Avant sa date de péremption, le produit peut être conservé à une température ne dépassant pas 25 °C pour une durée maximale de 6 mois avant utilisation.
Si le médicament n’est pas utilisé pendant cette période, il doit être jeté.
Une fois que le produit a été sorti du réfrigérateur, il ne doit pas y être replacé. La date à laquelle le médicament est sorti du réfrigérateur doit être notée sur l’emballage.
Pour les conditions de conservation du médicament après reconstitution, voir la rubrique 6.3.
6.5. Nature et contenu de l'emballage extérieur
500 UI de poudre dans un flacon (verre de type II) avec bouchon (bromobutyle) + 20 mL de solvant dans un flacon (verre de type I) avec bouchon (chlorobutyle recouvert de Flurotec) + aiguille de transfert - emballage à l’unité.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Dissolution
La fraction protéique sèche doit être dissoute dans le volume d’eau pour préparations injectables prescrit. En cas de conservation à 2 °C – 8 °C, il est nécessaire de porter les flacons de COFACT et l’eau pour préparations injectables à température ambiante (15 °C – 25 °C) avant de dissoudre la préparation.
Procédure à l’aide d’une aiguille de transfert
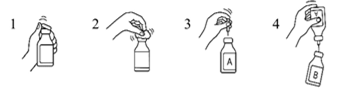
1. Retirer les capuchons protecteurs en plastique du flacon contenant l’eau pour préparations injectables et du flacon contenant le produit.
2. Désinfecter les bouchons en caoutchouc de chacun des flacons à l’aide d’une compresse de gaze imbibée d’alcool (70 %).
3. Retirer l’enveloppe protectrice de l’une des extrémités de l’aiguille de transfert et insérer l’aiguille dans le flacon contenant l’eau pour préparations injectables (A).
4. Retirer ensuite l’enveloppe protectrice de l’autre extrémité de l’aiguille de transfert, retourner le flacon dans lequel est insérée l’aiguille de transfert et insérer immédiatement l’autre extrémité de l’aiguille toujours libre dans le flacon contenant le produit (B).
La sous-pression dans le flacon contenant le produit aura pour effet d’aspirer l’eau pour préparations injectables dans le flacon. Recommandation : pendant le transfert dans le flacon de l'eau pour préparations injectables, le flacon contenant le produit doit être maintenu en position inclinée de manière à permettre l'écoulement de l’eau le long de la paroi du flacon. Cela permet de dissoudre plus rapidement le produit. Dès que l’eau est entièrement passée dans le flacon, le flacon vide et l’aiguille de transfert doivent être retirés d'un seul geste.
|
|
Afin d’accélérer le processus de dissolution, le flacon peut être remué délicatement et, si nécessaire, réchauffé à la température de 30 °C. Le flacon ne doit pas être agité et la température ne doit être portée au-delà de 37 °C. Si le flacon est réchauffé au bain-marie, il convient de s’assurer que l’eau n’entre pas en contact avec le capuchon protecteur et/ou le bouchon de caoutchouc.
Généralement, la substance sèche doit être dissoute dans les 10 minutes pour former une solution de couleur bleue, cette couleur étant due à la présence de la protéine plasmatique céruloplasmine.
La solution doit être transparente ou légèrement opalescente. N'utilisez pas de solutions troubles ou contenant des dépôts. Avant administration, le produit reconstitué doit faire l’objet d’une inspection visuelle destinée à détecter toute particule de matière et toute décoloration.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
PROTHYA BIOSOLUTIONS NETHERLANDS B.V.
PLESMANLAAN 125
1066 CX AMSTERDAM
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 571 052 2 8: 250 UI de poudre dans un flacon (verre de type I) avec bouchon (bromobutyle) + 10 mL de solvant dans un flacon (verre de type I) avec bouchon (bromobutyle) + aiguille de transfert - emballage à l’unité.
· 34009 571 053 9 6: 500 UI de poudre dans un flacon (verre de type II) avec bouchon (bromobutyle) + 20 mL de solvant dans un flacon (verre de type I) avec bouchon (chlorobutyle recouvert de Flurotec) + aiguille de transfert - emballage à l’unité.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament soumis à prescription hospitalière.