RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 05/09/2023
1. DENOMINATION DU MEDICAMENT
DEXAMETHASONE EIGNAPHARMA 4 mg/1 mL, solution injectable/pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Phosphate de dexaméthasone.................................................................................................. 4 mg
sous forme de phosphate sodique de dexaméthasone
Pour 1 mL de solution.
Chaque ampoule de 1 mL contient du phosphate sodique de dexaméthasone, équivalent à 4 mg de phosphate de dexaméthasone.
Excipient à effet notoire :
Chaque ampoule de 1 mL contient environ 2,8 mg de sodium.
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Solution injectable/pour perfusion.
Solution claire et incolore.
pH : 7,5 - 8,5.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
Administration systémique
· œdème cérébral des tumeurs cérébrales, interventions neurochirurgicales, abcès cérébral, méningite bactérienne (telles que tuberculose, typhoïde, brucellose) ;
· état de choc chez les polytraumatisés/prévention du syndrome respiratoire aigu post traumatique ;
· crise d'asthme sévère ;
· traitement parentéral des dermatoses aiguës étendue sévères (telles que érythrodermie, le pemphigus vulgaire, poussées d’eczéma)
· traitement parentéral des maladies auto-immunes tel que lupus érythémateux systémique (en particulier avec atteintes viscérales) ;
· polyarthrite rhumatoïde d’évolution sévère et progressive, par exemple des formes destructrices à évolution rapide et/ou des manifestations extra-articulaires ;
· traitement palliatif des tumeurs malignes ;
· prophylaxie et traitement des vomissements postopératoires ou induits par un traitement cytostatique dans le cadre de traitements antiémétiques.
· DEXAMETHASONE EIGNAPHARMA est indiqué dans le traitement de la maladie à coronavirus 2019 (COVID-19) chez les patients adultes et adolescents (âgés de 12 ans et plus avec un poids corporel d'au moins 40 kg) oxygeno-requérants complémentaire.
Administration locale
· injection intra-articulaire : inflammation persistante d'une ou de quelques articulations après prise en charge générale de maladies articulaires inflammatoires chroniques, poussée d’arthrose, formes aiguës de périarthropathie huméroscapulaire ;
· thérapie d'infiltration (lorsqu’elle est strictement indiquée) : tendosynovite et bursites non bactérienne, polyarthropathie, tendinopathie insertionnelle.
4.2. Posologie et mode d'administration
Posologie
La posologie dépend de la nature et de la gravité de la maladie et de la réponse individuelle du patient au traitement. En général, des doses initiales relativement élevées sont administrées et elles devraient être significativement plus élevées dans les formes aiguës sévères que dans les maladies chroniques.
Sauf indication contraire, les recommandations posologiques suivantes s'appliquent :
Administration systémique
· Œdème cérébral :
Adultes : selon la cause et la gravité, une dose initiale de 8 à 10 mg (jusqu'à 80 mg) en I.V., suivie de 16 à 24 mg (jusqu'à 48 mg)/jour en I.V., divisée en 3 à 4 (6) doses individuelles pendant 4 à 8 jours. Une administration à plus long terme et à plus faible dose de DEXAMETHASONE EIGNAPHARMA peut être nécessaire pendant l'irradiation et dans le traitement conservateur des tumeurs cérébrales inopérables.
· Œdème cérébral dû à une méningite bactérienne : 0,15 mg/kg de poids corporel toutes les 6 heures pendant 4 jours, enfants 0,4 mg/kg de poids corporel toutes les 12 heures pendant 2 jours ; commençant avant la première administration de l'antibiotique. Cas graves, états toxiques (par exemple tuberculose, typhoïde ; uniquement avec un traitement anti-infectieux concomitant) : 4 à 20 mg/jour en I.V., dans des cas uniques (par exemple typhoïde) initialement jusqu'à 200 mg.
Il convient de tenir compte des recommandations officielles concernant le recours à la corticothérapie pour la prise en charge adéquate des maladies infectieuses.
· Choc post-traumatique/prophylaxie du syndrome pulmonaire-choc post-traumatique : initialement 40 à 100 mg (enfants 40 mg) en I.V., une dose répétée après 12 heures ou 16 à 40 mg toutes les 6 heures pendant 2 à 3 jours.
· Crise d'asthme aiguë sévère :
Adultes : 8 à 20 mg en I.V., le plus tôt possible.
Enfants : 0,15 à 0,3 mg/kg de poids corporel en I.V. Les doses doivent être répétées si nécessaire, en fonction de la réponse individuelle et des besoins cliniques.
· Maladies aiguës de la peau : Selon la nature et l'étendue de la maladie, des doses quotidiennes de 8 à 40 mg I.V., dans les cas graves jusqu'à 100 mg. Suivi d'un traitement à doses décroissantes.
· Phases actives des maladies systémiques rhumatismales : lupus érythémateux disséminé 6 à 16 mg/jour.
· Polyarthrite rhumatoïde active avec évolution sévère et progressive : sous formes destructrices rapides 12 à 16 mg/jour, dans les manifestations extra-articulaires 6 à 12 mg/jour.
· Traitement palliatif des tumeurs malignes : initialement 8 à 16 mg/jour, en traitement prolongé 4 à 12 mg/jour.
· Prophylaxie et traitement des vomissements induits par traitement cytostatique dans les traitements antiémétiques : 8 à 20 mg en I.V., avant de commencer la chimiothérapie, puis 4 à 8 mg une à deux fois par jour pendant 2 à 3 jours si nécessaire (chimiothérapie modérément émétogène) ou jusqu'à 3 à 4 jours (chimiothérapie hautement émétisante).
· Prophylaxie et traitement des vomissements postopératoires : une dose unique de 4 à 8 mg en I.V., avant le début de la chirurgie ; chez les enfants de plus de 2 ans : 0,15 mg/kg de poids corporel (max. jusqu'à 8 mg).
· Covid-19 :
Adultes : 7,2 mg de phosphate de dexaméthasone (équivalent à 6 mg de dexaméthasone base) en IV, une fois par jour pendant 10 jours maximum.
Population pédiatrique
Chez les patients pédiatriques (adolescents âgés de 12 ans et plus) la dose recommandée est de 7,2 mg (ce qui équivaut à 6 mg de dexaméthasone base) en IV une fois par jour pendant 10 jours maximum.
La durée du traitement doit être guidée par la réponse clinique et les besoins individuels du patient.
Personnes âgées, insuffisance rénale, insuffisance hépatique : aucun ajustement de dose n'est nécessaire.
Administration locale
L'infiltration locale et le traitement par injection sont généralement effectués avec 4 à 8 mg ; 2 mg de phosphate de sodium de dexaméthasone sont suffisants s'ils sont injectés dans de petites articulations.
Mode d’administration
DEXAMETHASONE EIGNAPHARMA doit être administré par injection intraveineuse lente (plus de 2 à 3 minutes) ou par perfusion, mais peut également être administré par voie intramusculaire si des problèmes d'accès veineux se produisent et si la circulation sanguine est adéquate. DEXAMETHASONE EIGNAPHARMA peut également être administré par infiltration et par injection intra-articulaire. La durée du traitement dépend de l'indication.
Dans l'hypothyroïdie ou la cirrhose du foie, de faibles doses peuvent être suffisantes ou une réduction de dose peut être nécessaire.
L'administration par injection intra-articulaire doit être considérée comme une procédure articulaire ouverte et réalisée dans des conditions d'asepsie strictes. Une seule injection intra-articulaire est généralement suffisante pour un soulagement efficace des symptômes. Si une injection répétée est nécessaire, elle ne doit pas être administrée avant 3 à 4 semaines. Pas plus de 3 à 4 injections doivent être réalisées sur une articulation. Un contrôle médical de l'articulation est nécessaire, surtout après des injections répétées.
Infiltration : La zone la plus douloureuse ou celle des attaches tendineuses est infiltrée avec DEXAMETHASONE EIGNAPHARMA. Attention, ne pas injecter dans le tendon ! Les injections fréquentes doivent être évitées et des précautions aseptiques strictes doivent être observées.
Dans le cas où des doses élevées sont nécessaires en un seul traitement, l'utilisation de médicaments à base de dexaméthasone avec des dosages/volumes plus élevés doit être envisagée.
Conformité en vue de l’utilisation :
Seules des solutions limpides doivent être utilisées. Le contenu de l'ampoule est destiné à un usage unique. Toute solution injectable restante doit être jetée.
Voir section 6.6 pour les informations de compatibilité.
4.3. Contre-indications
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Infection fongique systémique ; infection systémique, sauf si un traitement anti-infectieux spécifique est utilisé.
L'injection intra-articulaire est contre-indiquée :
· si l'infection est présente dans ou à proximité immédiate de l'articulation à traiter ;
· dans l'arthrite bactérienne ;
· en cas d’instabilité de l'articulation à traiter ;
· en cas de tendance aux saignements (spontanément ou dus à des agents anticoagulants) ;
· en cas de calcification péri-articulaire ;
· dans la nécrose osseuse avasculaire ;
· en cas de rupture de tendon ;
· en cas d’articulation de Charcot.
L'infiltration sans traitement causal supplémentaire est contre-indiquée si l'infection est présente dans la zone d'administration.
4.4. Mises en garde spéciales et précautions d'emploi
Des cas uniques de réactions anaphylactiques sévères avec collapsus circulatoire, arrêt cardiaque, arythmie, bronchospasme et/ou hypotension ou hypertension ont été observés avec l'utilisation de dexaméthasone.
Grâce à l'immunosuppression, le traitement par DEXAMETHASONE EIGNAPHARMA peut entraîner un risque accru d'infections bactériennes, virales, parasitaires, opportunistes et fongiques. Il peut masquer les symptômes d'une infection existante ou en développement, rendant ainsi le diagnostic plus difficile. Les infections latentes, comme la tuberculose ou l'hépatite B, peuvent être réactivées.
En cas de situations particulières de stress physique (traumatisme, chirurgie, accouchement, etc.) pendant le traitement par DEXAMETHASONE EIGNAPHARMA, une augmentation temporaire de la dose peut être nécessaire.
Le traitement par DEXAMETHASONE EIGNAPHARMA ne doit être administré qu'en cas d’indications strictes et, si nécessaire, d'un traitement anti-infectieux ciblé supplémentaire si l'un des éléments suivants est présent :
· infections virales aiguës (hépatite B, zona, herpès simplex, varicelle, kératite herpétique) ;
· hépatite chronique active Ag HBs positive ;
· environ 8 semaines avant jusqu’à 2 semaines après la vaccination avec des vaccins vivants ;
· mycoses et parasitoses systémiques (p. ex. nématodes) ;
· chez les patients atteints de strongyloïdose soupçonnée ou confirmée (infection par les vers filamenteux), les glucocorticoïdes peuvent entraîner l'activation et la prolifération massive de ces parasites ;
· poliomyélite ;
· lymphadénite après vaccination au BCG ;
· infections bactériennes aiguës et chroniques ;
· chez les patients ayant des antécédents de tuberculose, utiliser uniquement sous protection tuberculostatique.
En outre, le traitement avec DEXAMETHASONE EIGNAPHARMA ne doit être administré qu’en cas d’indications strictes et, si nécessaire, un traitement spécifique supplémentaire doit être prévu pour :
· ulcères gastro-intestinaux ;
· ostéoporose ;
· insuffisance cardiaque sévère ;
· hypertension artérielle difficile à contrôler ;
· diabète sucré difficile à contrôler ;
· troubles psychiatriques (également dans le passé), y compris suicidalité : une surveillance neurologique ou psychiatrique est recommandée ;
· glaucome à angle fermé et angle ouvert : une surveillance ophtalmique et un traitement d'appoint sont recommandés ;
· ulcérations cornéennes et lésions cornéennes : une surveillance ophtalmique et un traitement d'appoint sont recommandés.
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale (CRSC), décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
En raison du risque de perforation intestinale, DEXAMETHASONE EIGNAPHARMA ne peut être utilisé qu’en cas d’indication urgente et sous surveillance appropriée pour :
· colite ulcéreuse sévère avec menace de perforation, éventuellement sans irritation péritonéale ;
· diverticulite ;
· entéro-anastomose (immédiatement après l'opération).
Les signes d'irritation péritonéale après perforation gastro-intestinale peuvent être absents chez les patients recevant des doses élevées de glucocorticoïdes.
La possibilité d'un besoin accru d'insuline ou d'antidiabétiques oraux doit être prise en considération lors de l'administration de DEXAMETHASONE EIGNAPHARMA à des diabétiques.
Une surveillance régulière de la pression artérielle est nécessaire pendant le traitement par DEXAMETHASONE EIGNAPHARMA, en particulier lors de l'administration de doses plus élevées et chez les patients souffrant d'hypertension artérielle difficile à contrôler.
En raison du risque de détérioration, les patients souffrant d'insuffisance cardiaque sévère doivent être étroitement surveillés.
Avec de fortes doses de dexaméthasone, une bradycardie peut survenir.
Des réactions anaphylactiques graves peuvent survenir.
Le risque de troubles tendineux, de tendinite et de rupture tendineuse est accru lorsque les fluoroquinolones et les glucocorticoïdes sont administrés ensemble.
Une myasthénie concomitante peut initialement s'aggraver pendant le traitement par DEXAMETHASONE EIGNAPHARMA.
Les vaccinations avec des vaccins inactivés sont généralement possibles. Cependant, il convient de noter que la réponse immunitaire et donc le vaccin peuvent être compromis à des doses plus élevées de corticostéroïdes.
Aux doses élevées, un apport suffisant en potassium et une restriction en sodium doivent être assurés et les taux sériques de potassium doivent être surveillés.
L'arrêt brusque du traitement après environ 10 jours peut entraîner une exacerbation ou une rechute de la maladie sous-jacente et une insuffisance corticosurrénalienne aiguë/un syndrome de sevrage de la cortisone. Par conséquent, la dose doit être réduite lentement si le traitement doit être interrompu.
Certaines maladies virales (varicelle, rougeole) peuvent être très graves chez les patients traités aux glucocorticoïdes. Les patients immunodéprimés qui n'ont jamais été infectés par la varicelle ou la rougeole sont particulièrement à risque. Si ces patients sont en contact avec des personnes infectées par la rougeole ou la varicelle pendant qu'ils suivent un traitement par DEXAMETHASONE EIGNAPHARMA, un traitement préventif devrait être initié, si nécessaire.
Au cours de l'expérience de post-commercialisation, un syndrome de lyse tumorale (SLT) a été signalé chez des patients présentant des tumeurs malignes hématologiques après l'utilisation de la dexaméthasone seule ou en association avec d'autres agents chimiothérapeutiques. Le patient à haut risque de SLT, comme les patients avec un taux élevé de prolifération, une charge tumorale élevée et une sensibilité élevée aux agents cytotoxiques, doit être surveillé étroitement et les précautions appropriées doivent être prises.
L'administration intraveineuse doit se faire par injection lente (plus de 2 à 3 minutes), car des effets secondaires tels que des picotements désagréables ou des paresthésies peuvent survenir s'ils sont injectés trop rapidement.
DEXAMETHASONE EIGNAPHARMA est destiné à une utilisation à court terme. En cas d'utilisation incorrecte sur une période plus longue, des avertissements et des précautions supplémentaires, tels que décrits pour l'administration à long terme de médicaments contenant des glucocorticoïdes, doivent être envisagés.
Les éventuels effets secondaires et interactions systémiques doivent être pris en compte après administration locale.
L'administration intra-articulaire de glucocorticoïdes augmente le risque d'infections articulaires. L'administration à long terme et les injections répétées de glucocorticoïdes dans les articulations portantes peuvent aggraver les modifications des articulations liées à l'usure. Cela est probablement dû à une surcharge des articulations touchées après que la douleur ou d'autres symptômes ont été soulagés.
Les corticostéroïdes systémiques ne doivent pas être arrêtés pour les patients qui sont déjà traités avec des corticostéroïdes systémiques (oraux) pour d'autres raisons (par exemple, les patients atteints de maladie pulmonaire obstructive chronique) mais qui n'ont pas besoin d'oxygène supplémentaire.
Crise de phéochromocytome
Une crise de phéochromocytome, pouvant être fatale, a été rapportée après administration des corticostéroïdes par voie systémique. Les corticostéroïdes ne doivent être administrés aux patients présentant un phéochromocytome suspecté ou avéré qu'après une évaluation appropriée du rapport bénéfice/risque.
Cardiomyopathie hypertrophique
Une cardiomyopathie hypertrophique a été rapportée après une administration systémique de corticostéroïdes incluant de ladexaméthasone à des nourrissons prématurés. Dans la majorité des cas signalés, cette situation était réversible à l’arrêt du traitement. Chez les nourrissons prématurés traités par dexaméthasone systémique, une évaluation diagnostique et une surveillance de la fonction et de la structure cardiaques doivent être réalisées (rubrique 4.8).
Population pédiatrique
Chez les nouveau-nés prématurés :
Les données disponibles suggèrent des effets indésirables sur le développement neurologique à long terme après un traitement précoce (initié dans les premières 96 heures qui suivent la naissance) des nouveau-nés prématurés atteints de maladie pulmonaire chronique à des doses de départ de 0,25 mg/kg deux fois par jour.
Dans la phase de croissance des enfants, le rapport bénéfice/risque du traitement par DEXAMETHASONE EIGNAPHARMA doit être évalué avec attention.
Patients âgés
Étant donné que les patients âgés présentent un risque accru d'ostéoporose, le rapport bénéfice/risque du traitement par DEXAMETHASONE EIGNAPHARMA doit être évalué avec attention.
Utilisation chez les sportifs
L'utilisation de DEXAMETHASONE EIGNAPHARMA peut conduire à des résultats positifs dans les contrôles antidopage.
Informations importantes concernant certains composants
Ce médicament contient 2.8 mg de sodium par ampoule, ce qui équivaut à 0,14 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium par adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
Œstrogènes (par exemple contraceptifs oraux) : La demi-vie des glucocorticoïdes peut être prolongée. Par conséquent, l'effet des corticoïdes peut être accru.
Médicaments qui induisent le CYP3A4, tels que la rifampicine, la phénytoïne, la carbamazépine, les barbituriques et la primidone : L'effet des corticoïdes peut être réduit.
Les inhibiteurs du CYP3A4 (y compris le kétoconazole, l'itraconazole, le ritonavir et le cobicistat) peuvent réduire la clairance de la dexaméthasone, ce qui peut entraîner une augmentation de l'effet et une suppression surrénalienne/un syndrome de Cushing. Cette association doit être évitée, sauf dans les cas où le bénéfice du traitement l'emporte sur le risque accru d'effets indésirables systémiques des corticostéroïdes. Si tel est le cas, les patients doivent être surveillés pour les effets systémiques des corticostéroïdes.
Éphédrine : Le métabolisme des glucocorticoïdes peut être accéléré et donc leur efficacité réduite.
Inhibiteurs de l'ECA : Risque accru de modifications de la formule sanguine.
Glycosides cardiaques : L'effet des glycosides peut être accru par une carence en potassium.
Salurétiques/laxatifs : L'excrétion de potassium peut être augmentée.
Antidiabétiques : L'effet hypoglycémiant peut être réduit.
Dérivés de la coumarine : L'effet anticoagulant peut être réduit ou augmenté. Un ajustement posologique de l'anticoagulant peut être nécessaire en cas de co-administration.
Anti-inflammatoires non stéroïdiens (AINS), salicylates et indométhacine : Le risque d'ulcères gastro-intestinaux et de saignements est accru.
Relaxants musculaires non dépolarisants : L'effet relaxant musculaire peut durer plus longtemps.
Atropine, autres anticholinergiques : Des augmentations supplémentaires de la pression intraoculaire sont possibles lors d'une utilisation concomitante.
Praziquantel : Les corticostéroïdes peuvent entraîner une baisse de la concentration de praziquantel dans le sang.
Chloroquine, hydroxychloroquine, méfloquine : Il existe un risque accru de myopathies, de cardiomyopathies.
Protiréline : Une augmentation réduite de la TSH peut être observée pendant l'administration de protiréline.
Agents immunosuppresseurs : Sensibilité accrue aux infections et éventuellement aggravation ou manifestation d'infections latentes. De plus, pour la cyclosporine, les niveaux sanguins de cyclosporine sont augmentés, il y a un risque accru de convulsions.
Les fluoroquinolones peuvent augmenter le risque de troubles tendineux.
Effet sur les méthodes d'investigation : Les réactions cutanées lors des tests d'allergie peuvent être supprimées.
4.6. Fertilité, grossesse et allaitement
Grossesse
La dexaméthasone traverse le placenta. Pendant la grossesse, en particulier au cours du premier trimestre, ce médicament ne doit être administré qu'après une évaluation approfondie du rapport bénéfice/risque.
Lors d'un traitement à long terme avec des glucocorticoïdes pendant la grossesse, les troubles de la croissance fœtale ne peuvent être exclus.
L'administration de corticostéroïdes à des animaux gravides peut provoquer des anomalies du développement fœtal, notamment une fente palatine, un retard de croissance intra-utérin et des effets sur la croissance et le développement du cerveau. Il n'y a aucune preuve que les corticostéroïdes entraînent une incidence accrue d'anomalies congénitales, telles que fente palatine/lèvre chez l'Homme (voir rubrique 5.3).
Si des glucocorticoïdes sont administrés vers la fin de la grossesse, il existe un risque d'atrophie du cortex surrénal fœtal, qui peut nécessiter un traitement de remplacement chez le nouveau-né, qui doit être lentement réduit.
Les études ont montré un risque accru d’hypoglycémie néonatale à la suite de l’administration de corticostéroïdes, y compris de dexaméthasone, pendant une courte période chez des femmes à risque d’accouchement prématuré tardif.
Allaitement
La dexaméthasone est excrétée dans le lait maternel. Il n'y a eu aucun cas connu de préjudice à l'enfant. Néanmoins, le médicament doit être utilisé qu'en cas d’indications strictes pendant la lactation. Si la maladie nécessite des doses plus élevées, l'allaitement doit être interrompu.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Rien n'indique que DEXAMETHASONE EIGNAPHARMA affecte la capacité de participer activement à la circulation routière ou d'utiliser des machines ou de travailler sans assurer une plus grande sécurité.
4.8. Effets indésirables
Le risque d'effets indésirables est faible lors d'un traitement à court terme par la dexaméthasone, à l'exception d'un traitement parentéral à forte dose où des changements d'électrolytes, des œdèmes, une augmentation éventuelle de la pression artérielle, un arrêt cardiaque, des troubles du rythme cardiaque ou des convulsions peuvent survenir, et des manifestations cliniques d'infections peuvent également être observées au cours d'un traitement à court terme. Une attention devra être portée aux éventuelles ulcérations gastriques et intestinales (souvent induites par le stress), car le traitement aux corticoïdes peut réduire leurs symptômes et diminuer la tolérance au glucose.
Les effets indésirables suivants peuvent survenir, ils dépendent fortement de la dose et de la durée du traitement, leur fréquence ne peut donc pas être spécifiée.
Infections et infestations :
Masquage des infections, manifestation et exacerbation des infections virales, infections fongiques, bactériennes, parasitaires et opportunistes, activation de la strongyloïdose (voir rubrique 4.4).
Affections hématologiques et du système lymphatique :
Leucocytose modérée, lymphocytopénie, éosinopénie, polycytémie.
Affections du système immunitaire :
Réactions d'hypersensibilité (ex. exanthème induit par des médicaments), réactions anaphylactiques sévères, telles que arythmies, bronchospasmes, hypo- ou hypertension, collapsus circulatoire, arrêt cardiaque, affaiblissement du système immunitaire.
Affections endocriniennes :
Syndrome de Cushing (symptômes typiques : visage lunaire, obésité centrale et pléthore), suppression surrénalienne (voir rubrique 4.4).
Troubles du métabolisme et de la nutrition :
Rétention de sodium avec œdème, augmentation de l'excrétion de potassium (risque d'arythmie), prise de poids, tolérance au glucose réduite, diabète sucré, hypercholestérolémie et hypertriglycéridémie, augmentation de l'appétit.
Affections psychiatriques :
Dépression, irritabilité, euphorie, entraînement accru, psychoses, manie, hallucinations, labilité émotionnelle, anxiété, troubles du sommeil, suicidalité.
Affections du système nerveux :
Hypertension intracrânienne bénigne, manifestation d'épilepsie latente, augmentation de la susceptibilité aux crises dans l'épilepsie diagnostiquée.
Affections oculaires :
Cataracte, en particulier avec opacité sous-capsulaire postérieure, glaucome, détérioration des symptômes associés à l'ulcère cornéen, augmentation de la fréquence des infections virales, fongiques et bactériennes de l'œil, détérioration des infections bactériennes de la cornée, ptose, mydriase, chimiose, perforation sclérale iatrogène, choriorétinopathie. Rares cas d'exophtalmie réversible, et après administration sous-conjonctivale également kératite à herpès simplex, perforation cornéenne en cas de kératite existante, vision trouble (voir également rubrique 4.4).
Affections cardiaques
Cardiomyopathie hypertrophique chez les nourrissons prématurés (voir rubrique 4.4).
Affections vasculaires :
Hypertension, risque accru d'athérosclérose et de thrombose, vascularite (également en tant que syndrome de sevrage après un traitement à long terme), augmentation de la fragilité capillaire.
Affections gastro-intestinales :
Ulcères gastro-intestinaux, saignements gastro-intestinaux, pancréatite, gêne gastrique, hoquet.
Affections de la peau et du tissu sous-cutané :
Stries rubra, atrophie, télangiectasie, pétéchies, ecchymose, hypertrichose, acné induite par les stéroïdes, dermatite de type rosacée (péri-orale), modifications de la pigmentation de la peau.
Affections musculosquelettiques et du tissu conjonctif :
Myopathie, atrophie et faiblesse musculaires, ostéoporose (dose-dépendante, possible également en administration à court terme), nécrose osseuse aseptique, troubles tendineux, tendinite, rupture tendineuse, lipomatose péridurale, inhibition de la croissance chez l'enfant.
Affections des organes de reproduction et du sein :
Troubles de la sécrétion d'hormones sexuelles (en conséquence : menstruations irrégulières jusqu'à l'aménorrhée, hirsutisme, impuissance).
Troubles généraux et anomalies au site d'administration :
Retard de cicatrisation des plaies.
Administration locale :
Des réactions locales d'irritation et d'intolérance sont possibles (sensation de chaleur, douleur prolongée). L'atrophie cutanée et l'atrophie du tissu sous-cutané au site d'injection ne peuvent être exclues si les corticoïdes ne sont pas soigneusement injectés dans la cavité articulaire.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
4.9. Surdosage
Symptômes
Les intoxications aiguës à la dexaméthasone ne sont pas connues. En cas de surdosage chronique, une augmentation des effets indésirables (voir rubrique 4.8), en particulier des effets endocriniens, métaboliques et électrolytiques, peut être attendue.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Corticoïdes à usage systémique, corticoïdes à usage systémique non associé, glucocorticoïdes, code ATC : H02AB02.
La dexaméthasone est un glucocorticoïde monofluoré aux propriétés et effets antiallergiques, anti-inflammatoires et stabilisateurs de membrane prononcés sur le métabolisme des glucides, des protéines et des graisses.
La dexaméthasone a un effet glucocorticoïde environ 7,5 fois plus important que la prednisolone et la prednisone, et par rapport à l'hydrocortisone, elle est 30 fois plus efficace, sans effets minéralocorticoïdes.
Les glucocorticoïdes, tels que la dexaméthasone, exercent leurs effets biologiques en activant la transcription des gènes sensibles aux corticostéroïdes. Les effets anti-inflammatoires, immunosuppresseurs et antiprolifératifs sont causés par une diminution de la formation, de la libération et de l'activité des médiateurs inflammatoires, par l'inhibition de fonctions spécifiques et la migration des cellules inflammatoires. De plus, les corticostéroïdes peuvent empêcher l'effet des lymphocytes T et des macrophages sensibilisés sur les cellules cibles.
Lorsqu'un traitement corticoïde à long terme est nécessaire, la possibilité d'induction d'une insuffisance surrénalienne transitoire doit être envisagée. La suppression de l'axe hypothalamo-hypophyso-surrénalien dépend également de facteurs individuels.
L'essai RECOVERY (de l’anglais « Randomised Evaluation of COVid-19 thERapY », soit « évaluation randomisée de la thérapie COVID-19 ») est un essai de plateforme adaptatif, contrôlé, en ouvert, randomisé individuellement à l'initiative de l'investigateur, visant à évaluer les effets de traitements potentiels chez des patients hospitalisés avec COVID-19.L'essai a été mené dans 176 organisations hospitalières au Royaume-Uni.6 425 patients randomisés ont reçu soit la dexaméthasone (2 104 patients), soit les soins habituels seuls (4 321 patients). 89 % des patients avaient une infection par le CoV-2 du SRAS confirmée en laboratoire. Au moment de la randomisation, 16 % des patients recevaient une ventilation mécanique invasive ou une oxygénation extracorporelle par membrane, 60 % recevaient uniquement de l'oxygène (avec ou sans ventilation non invasive) et 24 % ne recevaient ni l'un ni l'autre.
L'âge moyen des patients était de 66,1 ans +/-15,7 ans. 36 % des patients étaient des femmes. 24 % des patients avaient des antécédents de diabète, 27 % de maladies cardiaques et 21 % de maladies pulmonaires chroniques.
Paramètre primaire
La mortalité à 28 jours était significativement plus faible dans le groupe dexaméthasone que dans le groupe de soins habituels, avec des décès signalés respectivement chez 482 des 2 104 patients (22,9 %) et chez 1 110 des 4 321 patients (25,7 %) (rapport de taux, 0,83 ; intervalle de confiance [IC] à 95 %, 0,75 à 0,93 ; P<0,001).
Dans le groupe dexaméthasone, l'incidence des décès était inférieure à celle du groupe de soins habituels chez les patients recevant une ventilation mécanique invasive (29,3 % contre 41,4 % ; rapport de taux, 0,64 ; IC à 95 %, 0,51 à 0,81) et chez ceux recevant de l'oxygène supplémentaire sans ventilation mécanique invasive (23,3 % contre 26,2 % ; rapport de taux, 0,82 ; IC à 95 %, 0,72 à 0,94).
Il n'y a pas eu d'effet clair de la dexaméthasone chez les patients qui ne recevaient aucune assistance respiratoire au moment de la randomisation (17,8 % contre 14,0 % ; rapport de taux, 1,19 ; IC à 95 %, 0,91 à 1,55).
Paramètres secondaires
Les patients du groupe dexaméthasone ont eu une durée d'hospitalisation plus courte que ceux du groupe de soins habituels (médiane, 12 jours contre 13 jours) et une plus grande probabilité de sortir vivants dans les 28 jours (rapport de taux, 1,10 ; IC 95%, 1,03 à 1,17).
Conformément au paramètre primaire, l'effet le plus important concernant la sortie dans les 28 jours a été observé chez les patients qui recevaient une ventilation mécanique invasive au moment de la randomisation (rapport de taux, 1,48 ; IC à 95 %, 1,16, 1,90), suivi par l'oxygène uniquement (rapport de taux, 1,15 ; IC à 95 %, 1,06 à 1,24) sans effet bénéfique chez les patients ne recevant pas d'oxygène (rapport de taux, 0,96 ; IC à 95 %, 0,85 à 1,08).
|
Résultats
|
Dexaméthasone
(N = 2104)
|
Soins usuels
(N = 4321)
|
Risque relatif ou ratio
(95% CI) *
|
|
Nombre/Nombre total de patients (%)
|
|
Résultat primaire
|
|
Mortalité à 28 jours
|
482/2104 (22,9)
|
1110/4321 (25,7)
|
0,83 (0,75‑0,93)
|
|
Résultats secondaires
|
|
Sortie de l’hôpital sous 28 jours
|
1413/2104 (67,2)
|
2745/4321 (63,5)
|
1,10 (1,03‑1,17)
|
|
Ventilation mécanique invasive ou décès†
|
456/1780 (25,6)
|
994/3638 (27,3)
|
0,92 (0,84‑1,01)
|
|
Ventilation mécanique invasive
|
102/1780 (5,7)
|
285/3638 (7,8)
|
0,77 (0,62‑0.95)
|
|
Décès
|
387/1780 (21,7)
|
827/3638 (22,7)
|
0,93 (0,84‑1,03)
|
* Les risques relatifs ont été ajustés sur l’âge en fonction du taux de mortalité à 28 jours et du délai de sortie en vie de l’hôpital. Les risques relatifs ont été ajustés sur l’âge en fonction du taux de progression vers ventilation mécanique invasive ou de décès et des sous-composants.
† Les patients qui recevaient une ventilation mécanique invasive au moment de la randomisation ont été exclus de cette catégorie.
Données de sécurité
Quatre événements indésirables graves (EIG) ont été liés au traitement de l'étude : deux EIG d'hyperglycémie, un EIG de psychose induite par les stéroïdes et un EIG d'hémorragie gastro-intestinale supérieure. Tous les événements ont été résolus.
Analyses en sous-groupes
Effets de l’administration de la DEXAMÉTHASONE sur la mortalité à 28 jours, en fonction de l’âge et de l’assistance respiratoire reçue au moment de la randomisation
|
|
Dexaméthasone
|
Soins habituels
|
|
RR (IC 95 %)
|
|
Pas d’oxygène (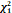 = 0,70; p=0,40) = 0,70; p=0,40)
|
|
<70
≥70 <80
≥80
Sous-total
|
10/197 (5,1 %)
25/114 (21,9 %)
54/190 (28,4 %)
89/501 (17,8 %)
|
18/462 (3,9 %)
35/224 (15,6 %)
92/348 (26,4 %)
145/1034 (14,0 %)
|
|
1,31 (0,60-2,83)
1,46 (0,88-2,45)
1,06 (0,76-1,49)
1,19 (0,91-1,55)
|
|
Oxygène seul ( =2,54; p=0,11) =2,54; p=0,11)
|
|
|
<70
≥70 <80
≥80
Sous-total
|
53/675 (7,9 %)
104/306 (34,0 %)
141/298 (47,3 %)
298/1279 (23,3 %)
|
193/1473 (13,1 %)
178/531 (33,5 %)
311/600 (51,8 %)
682/2604 (26,2 %)
|
0,58 (0,43-0,78)
0,98 (0,77-1,25)
0,85 (0,70-1,04)
0,82 (0,72-0,94)
|
|
Ventilation mécanique ( = 0,28; p=0,60) = 0,28; p=0,60)
|
|
|
<70
≥70 <80
≥80
Sous-total
Tous les participants
|
66/269 (24,5 %)
26/49 (53,1 %)
3/6 (50,0 %)
95/324 (29,3 %)
482/2104 (22,9 %)
|
217/569 (38,1 %)
58/104 (55,8 %)
8/10 (80,0 %)
283/683 (41,4 %)
1110/4321 (25,7 %)
|
0,61 (0,46-0,81)
0,85 (0,53-1,34)
0,39 (0,10-1,47)
0,64 (0,51-0,81)
0,83 (0,75-0,93)
p<0,001
|
|
|
|
|
Dexaméthasone plus efficace
|
Soins habituels
plus efficace
|
|
|
|
|
|
|
|
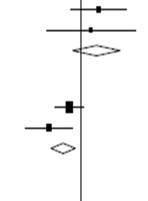
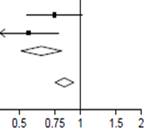
Effets de l’administration de la DEXAMÉTHASONE sur la mortalité à 28 jours, en fonction de l’assistance respiratoire reçue au moment de la randomisation et d’antécédents de maladie chronique
|
|
Dexaméthasone
|
Soins habituels
|
|
RR (IC 95 %)
|
|
Pas d’oxygène (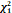 = 0,08; p=0,78) = 0,08; p=0,78)
|
|
Antécédent de maladie
Pas d’antécédent de maladie
Sous-total
|
65/313 (20,8 %)
24/188 (12,8 %)
89/501 (17,8 %)
|
100/598 (16,7 %)
45/436 (10,3 %)
145/1034 (14,0 %)
|
|
1,22 (0,89-1,66)
1,12 (0,68-1,83)
1,19 (0,91-1,55)
|
|
Oxygène seul (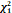 =2,05; p=0,15) =2,05; p=0,15)
|
|
|
Antécédent de maladie
Pas d’antécédent de maladie
Sous-total
|
221/702 (31,5 %)
77/577 (13,3 %)
298/1279 (23,3 %)
|
481/1473 (32,7 %)
201/1131 (17,8 %)
682/2604 (26,2 %)
|
0,88 (0,75-1,03)
0,70 (0,54-0,91)
0,82 (0,72-0,94)
|
|
Ventilation mécanique (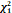 =1,52; p=0,22) =1,52; p=0,22)
|
|
|
Antécédent de maladie
Pas d’antécédent de maladie
Sous-total
Tous les participants
|
51/159 (32,1 %)
44/165 (26,7 %)
95/324 (29,3 %)
482/2104 (22,9 %)
|
150/346 (43,4 %)
133/337 (39,5 %)
283/683 (41,4 %)
1110/4321 (25,7 %)
|
0,75 (0,54-1,02)
0,56 (0,40-0,78)
0,64 (0,51-0,81)
0,83 (0,75-0,93)
p<0,001
|
|
|
|
|
Dexaméthasone plus efficace
|
Soins habituels
plus efficace
|
|
|
|
|
|
|
|
|
|
5.2. Propriétés pharmacocinétiques
La dexaméthasone se lie en fonction de la dose aux albumines plasmatiques. À des doses très élevées, la plus grande partie circule librement dans le sang. Dans l'hypoalbuminémie, la proportion de corticoïdes non liés (actifs) augmente. Quatre heures après l'administration intraveineuse de dexaméthasone radioactivement marquée chez l'homme, la concentration maximale de dexaméthasone dans le liquide cérébrospinal est d'environ 1/6 de sa concentration plasmatique.
Avec sa demi-vie biologique de plus de 36 heures, la dexaméthasone appartient aux glucocorticoïdes à très longue durée d’action. En raison de sa longue durée d'action, une accumulation et un surdosage peuvent survenir avec l'administration quotidienne et continue de dexaméthasone.
La demi-vie d'élimination sérique moyenne de la dexaméthasone chez l'adulte est d'environ 250 minutes (+ 80 minutes). Il est excrété principalement par le rein sous forme d'alcool libre de dexaméthasone. Il est partiellement métabolisé. Les métabolites sont, sous forme de glucuronates ou de sulfate, également principalement éliminés par les reins. La dysfonction rénale n'affecte pas substantiellement l'élimination de la dexaméthasone. La demi-vie d'élimination est prolongée en cas de maladie hépatique sévère.
5.3. Données de sécurité préclinique
Dans le cadre d’études sur les animaux, une fente palatine a été observée chez le rat, la souris, le hamster, le lapin, le chien et le primate; pas chez les chevaux et les moutons. Dans certains cas, ces divergences ont été associées à des défauts du système nerveux central et du cœur. Chez les primates, des effets sur le cerveau ont été observés après l'exposition. De plus, la croissance intra-utérine peut être retardée. Tous ces effets ont été observés à des doses élevées.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Edétate disodique, citrate de sodium, hydroxyde de sodium (pour l'ajustement du pH), eau pour préparations injectables.
6.2. Incompatibilités
Ce médicament ne doit pas être mélangé avec d'autres médicaments à l'exception de ceux mentionnés à la rubrique 6.6.
6.3. Durée de conservation
30 mois
Après ouverture, le médicament doit être utilisé immédiatement (voir rubrique 6.6).
Après dilution :
La stabilité physico-chimique en cours d'utilisation a été démontrée pendant 24 heures à 25 °C.
D'un point de vue microbiologique, à moins que la méthode d'ouverture n'exclue le risque de contamination microbienne, le produit doit être utilisé immédiatement. En cas d’utilisation non immédiate, les durées et conditions de conservation en cours d'utilisation sont de la responsabilité de de l'utilisateur.
6.4. Précautions particulières de conservation
À conserver à une température ne dépassant pas 30 °C.
Conserver les ampoules dans l’emballage extérieur, à l'abri de la lumière.
Ne pas réfrigérer.
6.5. Nature et contenu de l'emballage extérieur
Ampoule en verre transparent de type I contenant 1 mL de solution injectable/pour perfusion.
Présentations :
3, 10, 20 ou 100 X 1 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
DEXAMETHASONE EIGNAPHARMA 4 mg/1 mL, solution injectable/pour perfusion sera de préférence administrée par injection intraveineuse directe ou injecté dans le tube de perfusion. La solution injectable/pour perfusion est compatible avec les solutions de perfusion suivantes (chaque fois 250 ml et 500 ml) et doit être utilisé immédiatement :
· Chlorure de sodium 0,9 %
· La solution de Ringer
· Solution de glucose à 5 %
Lorsque le médicament est utilisé en association avec des solutions pour perfusion, les informations de chaque fournisseur sur leurs solutions pour perfusion, y compris les informations sur la compatibilité, les contre-indications, les effets indésirables et les interactions, doivent être prises en compte.
Ce médicament est à usage unique et doit être administré dès son ouverture. Tout médicament non utilisé doit être jeté.
Seules des solutions claires sans particules doivent être utilisées.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
EIGNAPHARMA S.L.
AVENIDA ERNEST LLUCH 32
TECNOCAMPUS TORRE TCM2 PLANTA 6
OFICINA 6.12 MATARO
BARCELONE 08302
ESPAGNE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 474 9 5 : 1 mL en ampoule (verre). Boîte de 3.
· 34009 302 475 0 1 : 1 mL en ampoule (verre). Boîte de 10.
· 34009 302 475 2 5 : 1 mL en ampoule (verre). Boîte de 20.
· 34009 550 874 8 9 : 1 mL en ampoule (verre). Boîte de 100.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Liste I.
![]() = 0,70; p=0,40)
= 0,70; p=0,40)
![]() =2,54; p=0,11)
=2,54; p=0,11)![]() = 0,28; p=0,60)
= 0,28; p=0,60)
