RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 31/05/2024
PEMETREXED SUN 7 mg/mL, solution pour perfusion
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque poche de perfusion de 100 mL contient 700 mg de pémetrexed (équivalent à 772,0 mg de pémetrexed disodique et équivalent à 978,6 mg de pémetrexed disodique heptahydraté).
Un mL de la solution pour perfusion contient 7,0 mg/mL de pémetrexed (équivalent à 9,79 mg de pémetrexed disodique heptahydraté).
Excipient à effet notoire :
Chaque poche de perfusion de 100 mL contient 429,4 mg (18,7 mmol) de sodium.
Un mL de la solution pour perfusion contient 4,294 mg de sodium.
|
Concentration de pémetrexed (mg/mL) |
Pémetrexed disodium (mg) |
Pémetrexed disodium heptahydrate (mg) |
Totale en sodium en mg/100 mL de produit |
mmol |
|
5 |
551.43 |
699.0 |
407.9 |
17.7 |
|
6 |
661.71 |
838.8 |
418.6 |
18.2 |
|
6.5 |
716.85 |
908.7 |
424.0 |
18.4 |
|
7 |
772.0 |
978.6 |
429.4 |
18.7 |
|
7.5 |
827.14 |
1048.5 |
434.8 |
18.9 |
|
8 |
882.28 |
1118.4 |
440.1 |
19.1 |
|
8.5 |
937.42 |
1183.3 |
445.5 |
19.4 |
|
9 |
992.57 |
1258.2 |
450.9 |
19.6 |
|
10 |
1102.85 |
1398.0 |
461.7 |
20.1 |
|
11 |
1213.14 |
1537.8 |
472.4 |
20.5 |
Pour la liste complète des excipients, voir rubrique 6.1.
Solution claire incolore à jaune ou vert-jaune, sans particules visibles, avec un pH de 6,0 à 8,0 et une osmolalité comprise entre 275 et 375 mOsmol/kg.
4.1. Indications thérapeutiques
PEMETREXED SUN, en association avec le cisplatine, est indiqué dans le traitement des patients atteints de mésothéliome pleural malin non résécable et qui n’ont pas reçu de chimiothérapie antérieure.
Cancer bronchique non à petites cellules
PEMETREXED SUN, en association avec le cisplatine, est indiqué dans le traitement en première ligne des patients atteints de cancer bronchique non à petites cellules localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde (voir rubrique 5.1).
PEMETREXED SUN est indiqué en monothérapie dans le traitement de maintenance du cancer bronchique non à petites cellules, localement avancé ou métastatique immédiatement à la suite d’une chimiothérapie à base de sel de platine, dès lors que l’histologie n’est pas à prédominance épidermoïde chez les patients dont la maladie n’a pas progressé (voir rubrique 5.1).
PEMETREXED SUN est indiqué en monothérapie dans le traitement en seconde ligne des patients atteints de cancer bronchique non à petites cellules, localement avancé ou métastatique, dès lors que l’histologie n’est pas à prédominance épidermoïde (voir rubrique 5.1).
4.2. Posologie et mode d'administration
Si la dose requise ne peut être obtenue avec les présentations disponibles, l'utilisation d'un produit alternatif à base de pémetrexed, y compris le pémetrexed sous forme de poudre pour concentré pour solution pour perfusion, est recommandée.
Posologie
PEMETREXED SUN doit être administré uniquement sous le contrôle d'un médecin qualifié dans l’utilisation des chimiothérapies anticancéreuses.
PEMETREXED SUN en association avec le cisplatine
La posologie recommandée de PEMETREXED SUN est de 500 mg/m2 de surface corporelle, en perfusion intraveineuse de 10 minutes, le premier jour de chaque cycle de 21 jours. La posologie recommandée de cisplatine est de 75 mg/m2 de surface corporelle en perfusion de 2 heures, débutée environ 30 minutes après la fin de la perfusion de pémétrexed, le premier jour de chaque cycle de 21 jours. Les patients doivent recevoir un traitement anti-émétique adéquat et une hydratation appropriée, avant et/ou après la perfusion de cisplatine (se référer au Résumé des Caractéristiques du Produit du cisplatine pour des recommandations posologiques spécifiques).
PEMETREXED SUN en monothérapie
Chez les patients traités pour cancer bronchique non à petites cellules et qui ont reçu une chimiothérapie antérieure, la posologie recommandée de PEMETREXED SUN est de 500 mg/m2 de surface corporelle, en perfusion intraveineuse de 10 minutes, le premier jour de chaque cycle de 21 jours.
Prémédication
Afin de réduire la survenue et la sévérité des réactions cutanées, une corticothérapie devra être administrée la veille, le jour même et le lendemain de l’administration du pémétrexed. La posologie doit être équivalente à 4 mg de dexaméthasone par voie orale, deux fois par jour (voir rubrique 4.4).
Afin de réduire la toxicité du pémétrexed, les patients traités doivent recevoir également une supplémentation en vitamines (voir rubrique 4.4). Les patients doivent prendre par voie orale de l'acide folique ou une association polyvitaminique contenant de l'acide folique (350 à 1 000 microgrammes) quotidiennement. Au moins cinq doses d’acide folique doivent être prises dans les 7 jours qui précèdent la première injection de pémétrexed, et les patients doivent continuer cette supplémentation pendant toute la durée du traitement et pendant 21 jours après la dernière injection de pémétrexed. Les patients doivent également recevoir une injection intramusculaire de vitamine B12 (1 000 microgrammes) dans la semaine précédant la première dose de pémétrexed puis une fois tous les trois cycles. Les injections ultérieures de vitamine B12 peuvent avoir lieu le même jour que l'administration de pémétrexed.
Surveillance
Avant chaque administration de pémétrexed, une numération-formule sanguine complète (NFS) avec mesure du taux de plaquettes doit être réalisée. Un bilan biochimique sera réalisé avant chaque administration de la chimiothérapie pour évaluer les fonctions hépatique et rénale.
Avant le début de chaque cycle de chimiothérapie, le nombre absolu de polynucléaires neutrophiles (PNN) doit être supérieur ou égal à 1 500 cellules/mm3 et le nombre de plaquettes supérieur ou égal à 100 000 cellules/mm3.
La clairance de la créatinine doit être supérieure ou égale à 45 mL/min.
Le taux de bilirubine totale doit être inférieur ou égal à 1,5 fois la limite supérieure de la normale. Les taux de phosphatases alcalines (PA), d’aspartate aminotransférase (ASAT ou SGOT) et d’alanine aminotransférase (ALAT ou SGPT) doivent être inférieurs ou égaux à 3 fois la limite supérieure de la normale. Des taux de phosphatases alcalines, d’ASAT et d’ALAT inférieurs ou égaux à 5 fois la limite supérieure de la normale sont acceptables en cas de métastases hépatiques.
Ajustements de la dose
Au début d’un nouveau cycle, les ajustements de dose s'appuieront sur la numération-formule sanguine au nadir et la toxicité non hématologique maximale observée au cours du cycle précédent. Le traitement peut être différé le temps nécessaire à la récupération. Dès récupération, les patients doivent être à nouveau traités selon les recommandations des tableaux 1, 2 et 3, qui concernent PEMETREXED SUN utilisé en monothérapie et en association avec le cisplatine.
|
Tableau 1 – Tableau de modification des doses de PÉMÉTREXED SUN (en monothérapie ou en association) et de cisplatine - Toxicités hématologiques |
|
|
Au nadir : PNN < 500 /mm3 et plaquettes ≥ 50 000 /mm3 |
75 % de la dose précédente (pour PEMETREXED SUN et le cisplatine) |
|
Au nadir : plaquettes < 50 000 /mm3 quel que soit le taux de PNN |
75 % de la dose précédente (pour PEMETREXED SUN et le cisplatine) |
|
Au nadir : plaquettes < 50 000 /mm3 avec saignementa, quel que soit le taux de PNN |
50 % de la dose précédente (pour PEMETREXED SUN et le cisplatine) |
a Ces critères répondent à la définition des saignements ≥ Grade 2 selon les Critères Communs de Toxicité (CTC) du National Cancer Institute (v2.0; NCI 1998).
En cas de toxicités non-hématologiques ≥ grade 3 (à l’exclusion d’une neurotoxicité), le traitement par PEMETREXED SUN doit être suspendu jusqu’à résolution à un niveau inférieur ou égal au niveau initial du patient avant traitement. Le traitement doit être poursuivi selon les recommandations du tableau 2.
|
Tableau 2 – Tableau de modification des doses de PÉMÉTREXED SUN (en monothérapie ou en association) et de cisplatine - Toxicités non-hématologiques a,b |
||
|
|
Dose de PÉMÉTREXED SUN (mg/m²) |
Dose de cisplatine (mg/m²) |
|
Toute toxicité de grade 3 ou 4, excepté mucite |
75 % de la dose précédente |
75 % de la dose précédente |
|
Toute diarrhée nécessitant une hospitalisation (quel que soit le grade) ou diarrhée de grade 3 ou 4 |
75 % de la dose précédente |
75 % de la dose précédente |
|
mucite de grade 3 ou 4 |
50 % de la dose précédente |
100 % de la dose précédente |
a Critères Communs de Toxicité (CTC) du National Cancer Institute (v2.0; NCI 1998).
b A l’exclusion d’une neurotoxicité.
En cas de neurotoxicité, il est recommandé d’ajuster les doses de PEMETREXED SUN et de cisplatine comme précisé dans le tableau 3. Les patients doivent arrêter le traitement si une neurotoxicité de grade 3 ou 4 est observée.
|
Tableau 3 – Tableau de modification des doses de PÉMÉTREXED SUN (en monothérapie ou en association) et de cisplatine - Neurotoxicité |
||
|
Grade CTCa |
Dose de PÉMÉTREXED SUN (mg/m²) |
Dose de cisplatine (mg/m²) |
|
0 - 1 |
100 % de la dose précédente |
100 % de la dose précédente |
|
2 |
100 % de la dose précédente |
50 % de la dose précédente |
a Critères Communs de Toxicité (CTC) du National Cancer Institute (v2.0; NCI 1998).
Le traitement par PEMETREXED SUN doit être arrêté si le patient présente une toxicité hématologique ou non hématologique de grade 3 ou 4 après 2 réductions de dose ou immédiatement si une neurotoxicité de grade 3 ou 4 est observée.
Populations particulières
Sujets âgés
Au cours des essais cliniques, il n’a pas été mis en évidence de risque plus élevé d’effets indésirables chez les patients de 65 ans et plus comparativement aux patients de moins de 65 ans. Des réductions de doses autres que celles recommandées pour l'ensemble des patients ne sont pas nécessaires.
Population pédiatrique
Il n’y a pas d’utilisation justifiée de PEMETREXED SUN dans la population pédiatrique dans le mésothéliome pleural malin et le cancer bronchique non à petites cellules.
Insuffisants rénaux (formule standard de Cockcroft et Gault ou taux de filtration glomérulaire mesuré par la méthode de clairance plasmatique Tc99m-DTPA)
Le pémétrexed est essentiellement éliminé sous forme inchangée dans les urines. Dans les études cliniques, des ajustements de doses autres que celles préconisées pour l'ensemble des patients n’ont pas été nécessaires chez les patients dont la clairance de la créatinine était ≥ 45 mL/min. Chez les patients ayant une clairance de la créatinine < 45 mL/min, les données sont insuffisantes ; l’utilisation du pémétrexed n’est donc pas recommandée chez ces patients (voir rubrique 4.4).
Insuffisants hépatiques
Aucune relation entre le taux d’ASAT (SGOT), d’ALAT (SGPT) ou de bilirubine totale et la pharmacocinétique du pémétrexed n’a été identifiée. Toutefois, il n'a pas été conduit d'étude spécifique chez des patients ayant une atteinte hépatique avec un taux de bilirubine supérieur à 1,5 fois la limite supérieure de la normale et/ou un taux d’aminotransférases supérieur à 3 fois la limite supérieure de la normale (en l’absence de métastases hépatiques) ou supérieur à 5 fois la limite supérieure de la normale (en cas de métastases hépatiques).
Mode d’administration
PEMETREXED SUN doit être administré en intraveineuse. PEMETREXED SUN doit être administré en perfusion intraveineuse de 10 minutes, le premier jour de chaque cycle de 21 jours.
La solution peut être administrée directement au patient sans autre préparation.
A usage unique.
· Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique 6.1.
· Allaitement (voir rubrique 4.6).
· Association concomitante avec le vaccin contre la fièvre jaune (voir rubrique 4.5).
4.4. Mises en garde spéciales et précautions d'emploi
Une moindre toxicité et une réduction des toxicités hématologiques et non-hématologiques de grade 3/4 telles que neutropénie, neutropénie fébrile et infections avec neutropénies de grade 3/4 ont été rapportées lorsqu’une prémédication par acide folique et vitamine B12 était administrée. Tous les patients traités par le pémétrexed doivent donc être informés de la nécessité de prendre de l’acide folique et de la vitamine B12 comme mesure prophylactique afin de réduire la toxicité liée au traitement (voir rubrique 4.2).
Des réactions cutanées ont été rapportées chez des patients n'ayant pas reçu de corticothérapie préalable. Une prémédication par dexaméthasone (ou équivalent) peut réduire l'incidence et la sévérité des réactions cutanées (voir rubrique 4.2).
Un nombre insuffisant de patients présentant une clairance de la créatinine < 45 mL/min a été étudié. Par conséquent, l’utilisation du pémétrexed chez les patients présentant une clairance de la créatinine inférieure à 45 mL/min n’est pas recommandée (voir rubrique 4.2).
Les patients atteints d’une insuffisance rénale faible à modérée (clairance de la créatinine comprise entre 45 mL/min et 79 mL/min) doivent éviter de prendre des anti-inflammatoires non stéroïdiens (AINS) tel que l’ibuprofène et l’acide acétylsalicylique (> 1,3 g par jour) les deux jours avant, le jour même et les deux jours suivant l’administration de pémétrexed (voir rubrique 4.5).
Chez les patients atteints d’insuffisance rénale légère à modérée susceptibles de recevoir un traitement par le pémétrexed, les AINS à demi-vie longue doivent être interrompus pendant au moins cinq jours avant, le jour même, et au moins les deux jours suivant l’administration de pémétrexed (voir rubrique 4.5).
Des effets rénaux graves, y compris une insuffisance rénale aiguë, ont été rapportés avec le pémétrexed en monothérapie ou en association avec d'autres agents cytotoxiques. La plupart des patients chez lesquels ces évènements sont survenus présentaient des facteurs de risque rénaux, incluant une déshydratation, une hypertension ou un diabète préexistants.
L’effet d’un troisième secteur liquidien, tel qu’un épanchement pleural ou une ascite, sur le pémétrexed n’est pas entièrement défini. Une étude de phase 2 du pémétrexed conduite chez 31 patients atteints de tumeurs solides et ayant un troisième secteur liquidien stable a démontré qu’il n’y avait pas de différence en termes de concentrations plasmatiques normalisées et de clairance du pémétrexed, comparés aux patients n’ayant pas de troisième secteur liquidien. Ainsi, une ponction évacuatrice d’une collection du troisième secteur liquidien avant l’administration de pémétrexed devrait être envisagée, mais peut ne pas être nécessaire.
En raison de la toxicité gastro-intestinale du pémétrexed administré en association avec le cisplatine, une déshydratation sévère a été observée. En conséquence, les patients doivent recevoir un traitement anti-émétique adéquat et une hydratation appropriée, avant et/ou après l’administration du traitement.
Des effets cardiovasculaires graves, y compris infarctus du myocarde, et des effets cérébrovasculaires ont été peu fréquemment rapportés pendant les études cliniques avec le pémétrexed, habituellement lorsque celui-ci est administré en association avec un autre agent cytotoxique. La plupart des patients chez lesquels ces évènements ont été observés avaient des facteurs de risque cardiovasculaire préexistants (voir rubrique 4.8).
L’immunodépression est fréquente chez les patients cancéreux. En conséquence, l’utilisation concomitante de vaccins vivants atténués n’est pas recommandée (voir rubriques 4.3 et 4.5).
Le pémétrexed peut entraîner des anomalies du matériel génétique. Il doit être conseillé aux hommes de ne pas concevoir d’enfant durant leur traitement et dans les 6 mois qui suivent son arrêt. Des mesures contraceptives ou l’abstinence sont recommandées. Une conservation de sperme peut être conseillée aux hommes avant de débuter le traitement en raison du risque de stérilité irréversible.
Les femmes en âge de procréer doivent utiliser un moyen de contraception efficace pendant le traitement par pémétrexed (voir rubrique 4.6).
Des cas de pneumopathie radique ont été rapportés chez des patients traités par radiothérapie, soit avant, pendant ou après une chimiothérapie par pémétrexed. Une attention particulière devra être portée à ces patients et il conviendra d'agir avec précaution lors de l'utilisation d'autres agents radiosensibilisants.
Des cas de réactivation de zone antérieurement irradiée ont été rapportés chez des patients préalablement traités par radiothérapie des semaines ou des années auparavant.
Pémetrexed 7 mg/mL contient 429,4 mg (18,7 mmol) de sodium par poche de perfusion. Cela équivaut à 20,4 % de l'apport maximal quotidien de 2 g de sodium recommandé par l'OMS pour un adulte.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
L’administration concomitante de substances également secrétées au niveau tubulaire (par exemple : le probénécide, la pénicilline) pourrait diminuer la clairance du pémétrexed. Des précautions doivent être prises lorsque ces médicaments sont associés au pémétrexed. Si nécessaire, la clairance de la créatinine devra être étroitement surveillée.
Chez les patients ayant une fonction rénale normale (clairance de la créatinine ≥ 80 mL/min), de fortes doses d’anti-inflammatoires non stéroïdiens (AINS, tel que l’ibuprofène > 1 600 mg/jour) et l’acide acétylsalicylique à dose plus élevée (≥ 1,3 g par jour) peuvent diminuer l’élimination du pémétrexed et par conséquent, augmenter la survenue d’effets indésirables dus au pémétrexed. Des précautions doivent donc être prises lors de l’administration concomitante de fortes doses d’AINS ou d’acide acétylsalicylique et de pémétrexed chez les patients ayant une fonction rénale normale (clairance de la créatinine ≥ 80 mL/min).
Chez les patients atteints d’une insuffisance rénale faible à modérée (clairance de la créatinine comprise entre 45 mL/min et 79 mL/min), l’administration concomitante de pémétrexed et d’AINS (par exemple l’ibuprofène) ou d’acide acétylsalicylique à dose plus élevée doit être évitée les deux jours avant, le jour même et les deux jours suivant l’administration de pémétrexed (voir rubrique 4.4).
En l’absence de données concernant les éventuelles interactions avec les AINS à demi-vie longue, tels que le piroxicam ou le rofecoxib, leur administration concomitante avec le pémétrexed chez les patients ayant une insuffisance rénale faible à modérée doit être interrompue pendant au moins cinq jours avant, le jour même, et au moins les deux jours suivant l’administration de pémétrexed (voir rubrique 4.4). Si l’administration concomitante d’AINS est nécessaire, les patients doivent faire l’objet d’une surveillance étroite de la toxicité, en particulier gastrointestinale et de la myélosuppression du pémétrexed.
Le pémétrexed fait l'objet d'un métabolisme hépatique limité. Les résultats d'études in vitro sur microsomes hépatiques humains suggèrent que le pémétrexed n'inhiberait pas de manière cliniquement significative la clairance métabolique des médicaments métabolisés par les iso-enzymes CYP3A, CYP2D6, CYP2C9 et CYP1A2.
Interactions communes à tous les cytotoxiques
En raison de l’augmentation du risque thrombotique chez les patients cancéreux, le recours à un traitement anticoagulant est fréquent. La grande variabilité intra-individuelle de la coagulabilité au cours des maladies, à laquelle s’ajoute l’éventualité d’une interaction entre les anticoagulants oraux et les cytotoxiques, imposent s’il est décidé de traiter le patient par anticoagulants oraux, d’augmenter la fréquence des contrôles de l’INR (International Normalised Ratio). Association concomitante contre-indiquée : vaccin contre la fièvre jaune : risque de maladie vaccinale généralisée mortelle (voir rubrique 4.3).
Association concomitante déconseillée : vaccins vivants atténués (excepté le vaccin contre la fièvre jaune, pour lequel l’association concomitante est contre-indiquée) : risque de maladie vaccinale généralisée éventuellement mortelle. Ce risque est majoré chez les sujets déjà immunodéprimés par leur maladie sous-jacente. Utiliser un vaccin inactivé lorsqu’il existe (poliomyélite) (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement
Femmes en âge de procréer/ Contraception chez les hommes et les femmes
Les femmes en âge de procréer doivent utiliser un moyen de contraception efficace pendant le traitement par pémétrexed.
Le pémétrexed peut entraîner des anomalies du matériel génétique. Il doit être conseillé aux hommes de ne pas concevoir d’enfant durant leur traitement et dans les 6 mois qui suivent son arrêt. Des mesures contraceptives ou l’abstinence sont recommandées.
Grossesse
Il n'y a pas de données concernant l’utilisation du pémétrexed chez la femme enceinte, cependant le pémétrexed, comme d’autres anti-métabolites, est suspecté d’entraîner des malformations lorsqu’il est administré pendant la grossesse. En effet, les études chez l'animal mettent en évidence une toxicité de la reproduction (voir rubrique 5.3). Le pémétrexed ne doit pas être utilisé chez la femme enceinte, sauf cas de nécessité absolue, après avoir évalué le bénéfice pour la mère et le risque pour le fœtus (voir rubrique 4.4).
Allaitement
On ne sait pas si pémétrexed est excrété dans le lait maternel et un risque d’effets indésirables chez le nouveau-né allaité ne peut être exclu. L’allaitement doit être interrompu au cours traitement avec le pémétrexed (voir rubrique 4.3).
Fertilité
Une conservation de sperme peut être conseillée aux hommes avant de débuter le traitement en raison du risque de stérilité irréversible.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Résumé du profil de sécurité
Les effets indésirables les plus fréquemment rapportés chez les patients traités par pémétrexed, en monothérapie ou en association, ont été une dépression médullaire à type d’anémie, neutropénie, leucopénie, thrombopénie ; ainsi que des toxicités gastro-intestinales, à type d’anorexie, nausées, vomissements, diarrhées, constipation, pharyngite, mucite et stomatite. D’autres effets indésirables incluent : toxicités rénales, élévation des aminotransférases, alopécie, fatigue, déshydratation, éruption cutanée, infection/sepsis et neuropathie. Des effets rarement observés incluent : syndrome de Stevens-Johnson et nécrolyse épidermique toxique.
Liste tabulée des effets indésirables
Le tableau 4 présente les événements indésirables, quel que soit le lien de causalité, associés au pémétrexed utilisé soit en monothérapie soit en association avec le cisplatine, issus des études pivotales d’enregistrement (JMCH, JMEI, JMBD, JMEN et PARAMOUNT) et de la notification spontanée post-commercialisation.
Les événements indésirables sont listés par classe de système d’organes selon la classification MedDRA. La convention suivante a été pour la classification par la fréquence : très fréquent: (≥ 1/10) ; fréquent : (≥ 1/100, < 1/10) ; peu fréquent : (≥ 1/1 000, < 1/100) ; rare : (≥ 1/10 000, < 1/1 000) ; très rare : (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 4. Fréquences des événements indésirables de tout grade, quel que soit le lien de causalité, issus des études pivotales d’enregistrement : JMEI (pémétrexed versus docétaxel), JMDB (pémétrexed et cisplatine versus gemcitabine et cisplatine), JMCH (pémétrexed plus cisplatine versus cisplatine), JMEN et PARAMOUNT (pémétrexed plus le meilleur traitement symptomatique versus placebo plus le meilleur traitement symptomatique) et de la notification spontanée post-commercialisation.
|
Classe de système d’organes (MedDRA) |
Très fréquent |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Fréquence indéterminée |
|
Infections et infestations |
Infectiona Pharyngite |
Sepsisb |
|
|
Dermo-hypodermite |
|
|
Affections hématologiques et du système lymphatique |
Neutropénie Leucopénie Diminution de l’hémoglobine |
Neutropénie fébrile Diminution du nombre de plaquettes |
Pancytopénie |
Anémie hémolytique auto-immune |
|
|
|
Affections du système immunitaire |
|
Hypersensibilité |
|
Choc anaphylactique |
|
|
|
Troubles du métabolisme et de la nutrition |
|
Déshydratation |
|
|
|
|
|
Affections du système nerveux |
|
Trouble du goût Neuropathie périphérique motrice Neuropathie périphérique sensorielle Sensations vertigineuses |
Accident vasculaire cérébral Accident vasculaire cérébral ischémique Hémorragie intracrânienne |
|
|
|
|
Affections oculaires |
|
Conjonctivite Sécheresse oculaire Hypersécrétion lacrymale Kérato-conjonctivite sèche Œdème palpébral Maladie de la surface oculaire |
|
|
|
|
|
Affections cardiaques |
|
Insuffisance cardiaque Arythmie |
Angor Infarctus du myocarde Coronaropathie Arythmie supra-ventriculaire |
|
|
|
|
Affections vasculaires |
|
|
Ischémie périphériquec |
|
|
|
|
Affections respiratoires, thoraciques et médiastinales |
|
|
Embolie pulmonaire Pneumopathie interstitiellebd |
|
|
|
|
Affections gastro-intestinales |
Stomatite Anorexie Vomissement Diarrhée Nausées |
Dyspepsie Constipation Douleur abdominale |
Hémorragie rectale Hémorragie gastro-intestinale Perforation intestinale Œsophagite Colitee |
|
|
|
|
Affections hépatobiliaires |
|
Elévation de l’alanine amino-transférase Elévation de l’aspartate amino-transférase |
|
Hépatite |
|
|
|
Affections de la peau et du tissus sous-cutané |
Eruption cutanée Exfoliation cutanée |
Hyperpigmentation Prurit Erythème polymorphe Alopécie Urticaire |
|
Erythème |
Syndrome de Stevens-Johnsonb Nécrolyse épidermique toxiqueb Pemphigoïde Dermatite bulleuse Epidermolyse bulleuse acquise Œdème érythémateuxf Pseudo-cellulite Dermatite Eczéma Prurigo |
|
|
Affections du rein et de voies urinaires |
Diminution de la clairance de la créatinine Augmentation de la créatininémiee |
Insuffisance rénale Diminution du débit de filtration glomérulaire |
|
|
|
Diabète insipide néphrogénique Nécrose tubulaire rénale |
|
Troubles généraux et anomalies au site d’administration |
Fatigue |
Pyrexie Douleur Œdème Douleur thoracique Inflammation des muqueuses |
|
|
|
|
|
Investigations |
|
Elévation de la gamma-glutamyl-transférase |
|
|
|
|
|
Lésions intoxications et complication liées aux procédures |
|
|
Œsophagite radique Pneumopathie radique |
Phénomène de rappel de la zone irradiée |
|
|
a avec et sans neutropénie
b avec des cas d’issue fatale
c conduisant parfois à une nécrose des extrémités
d avec une insuffisance respiratoire
e observé uniquement en association avec le cisplatine
f principalement des membres inférieurs
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Les symptômes rapportés en cas de surdosage incluent neutropénie, anémie, thrombopénie, mucite, polyneuropathie sensitive et éruption cutanée. Les complications prévisibles d'un surdosage incluent la dépression médullaire, se manifestant par une neutropénie, une thrombopénie et une anémie. De plus, une infection avec ou sans fièvre, une diarrhée et/ou une mucite peuvent être rapportées. En cas de suspicion de surdosage, la numération-formule sanguine des patients doit être surveillée et un traitement symptomatique sera mis en œuvre, selon les cas. L’utilisation d’acide folinique/folinate de calcium dans la prise en charge d’un surdosage de pémétrexed doit être envisagée.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmaco-thérapeutique : Analogues de l’acide folique, code ATC : L01BA04.
Le pémétexed est un agent antinéoplasique antifolate multi-cible qui agit en interrompant des processus métaboliques folate-dépendants essentiels à la réplication cellulaire.
Des études in vitro ont montré que le pémétrexed se comporte comme un anti-folate multi-cible en inhibant la thymidylate synthétase (TS), la dihydrofolate réductase (DHFR) et la glycinamide ribonucléotide formyltransférase (GARFT), qui sont des enzymes folate-dépendantes clés pour la biosynthèse de novo de la thymidine et des nucléotides puriques. Le pémétrexed est transporté dans les cellules à la fois par les systèmes de transport des folates réduits et les protéines membranaires transporteuses de folates. Une fois dans la cellule, le pémétrexed est rapidement et efficacement converti en formes polyglutamates par la folyl-polyglutamate synthétase. Ces formes polyglutamates sont retenues dans les cellules et sont des inhibiteurs encore plus puissants de la TS et de la GARFT. La polyglutamation est un processus temps et concentration-dépendant qui se déroule dans les cellules tumorales et, dans une moindre mesure, dans les tissus normaux.
Les métabolites polyglutamatés ont une demi-vie intracellulaire augmentée, prolongeant l'action du produit dans les cellules tumorales.
L’Agence Européenne du Médicament a accordé une dérogation à l’obligation de soumettre les résultats d’études réalisées avec le pémétrexed dans tous les sous-groupes de la population pédiatrique dans les indications autorisées (voir rubrique 4.2).
Efficacité clinique:
Mésothéliome
L’étude clinique de phase 3 multicentrique, randomisée, en simple aveugle EMPHACIS comparant le pémétrexed plus cisplatine versus cisplatine chez les patients atteints de mésothéliome pleural malin n’ayant pas reçu de chimiothérapie antérieure a montré que les patients traités par le pémétrexed et cisplatine avaient un avantage cliniquement significatif en terme de survie globale médiane de 2,8 mois par rapport aux patients traités par cisplatine seul.
Pendant cette étude, une supplémentation en acide folique à faible dose et en vitamine B12 a été introduite dans le traitement des patients afin d’en réduire la toxicité. L’analyse principale de cette étude a été effectuée sur la population de tous les patients randomisés dans un des bras ayant reçu le traitement correspondant (patients randomisés et traités). Une analyse de sous-groupe a été effectuée chez les patients qui ont reçu une supplémentation en acide folique et en vitamine B12 pendant toute la durée de leur traitement (patients totalement supplémentés). Les résultats d'efficacité de ces analyses sont résumés dans le tableau suivant :
Tableau 5. Résultats d’efficacité du pémétrexed + cisplatine versus cisplatine dans le mésothéliome pleural malin :
|
|
Patients randomisés et traités |
Patients totalement supplémentés |
||
|
Paramètre d’efficacité |
Pémétrexed / cisplatine (N = 226) |
Cisplatine (N = 222) |
Pémétrexed / cisplatine (N = 168) |
Cisplatine (N = 163) |
|
Survie globale médiane (mois) (IC 95 %) |
12,1 (10,0 - 14,4) |
9,3 (7,8 - 10,7) |
13,3 (11,4 - 14,9) |
10,0 (8,4 - 11,9) |
|
Test du log-rank (p*a) |
0,020 |
0,051 |
||
|
Temps médian jusqu’à progression tumorale (mois) (IC 95 %) |
5,7 (4,9 - 6,5) |
3,9 (2,8 - 4,4) |
6,1 (5,3 - 7,0) |
3,9 (2,8 - 4,5) |
|
Test du log-rank (p*a) |
0,001 |
0,008 |
||
|
Temps jusqu’à échec du traitement (mois) (IC 95 %) |
4,5 (3,9 - 4,9) |
2,7 (2,1 - 2,9) |
4,7 (4,3 - 5,6) |
2,7 (2,2 - 3,1) |
|
Test du log-rank (p*a) |
0,001 |
0,001 |
||
|
Taux de réponse globaleb** (IC 95 %) |
41,3 % (34,8 - 48,1) |
16,7 % (12,0 - 22,2) |
45,5 % (37,8 - 53,4) |
19,6 % (13,8 - 26,6) |
|
Test exact de Fisher (p*a) |
< 0,001 |
< 0,001 |
||
Abréviation : IC = intervalle de confiance
*a la valeur de p s’applique à la comparaison entre les bras
b** Dans le bras pémétrexed/cisplatine : patients randomisés et traités (N = 225) et patients supplémentés totalement (N = 167)
Une amélioration statistiquement significative des symptômes cliniquement importants (douleur et dyspnée) associés au mésothéliome pleural malin dans le bras pémétrexed/cisplatine (212 patients) comparé au bras cisplatine seul (218 patients) a été démontrée en utilisant l’échelle des symptômes du cancer du poumon « Lung Cancer Symptom Scale ».
Des différences statistiquement significatives dans le bilan de la fonction pulmonaire ont été également observées. La différence entre les deux bras a été démontrée par l’amélioration de la fonction pulmonaire dans le bras pémétrexed/cisplatine et la détérioration de celle-ci au cours du temps dans le bras contrôle.
Les données chez les patients atteints de mésothéliome pleural malin traités par pémétrexed seul sont limitées. Pémétrexed a été étudié à la dose de 500 mg/m² en monothérapie chez 64 patients atteints de mésothéliome pleural malin n'ayant jamais reçu de chimiothérapie. Le taux de réponse globale était de 14,1 %.
CBNPC, traitement en seconde ligne
Une étude clinique de phase 3 multicentrique, randomisée, en ouvert comparant le pémétrexed versus docétaxel chez des patients atteints de cancer bronchique non à petites cellules (CBNPC), localement avancé ou métastatique, ayant reçu une chimiothérapie antérieure a montré des temps de survie globale médiane de 8,3 mois pour les patients traités par le pémétrexed (population en Intention de Traiter n = 283) et de 7,9 mois pour les patients traités par docétaxel (population en Intention de Traiter n = 288). La chimiothérapie antérieure n’incluait pas le pémétrexed. Une analyse de l’impact de l’histologie du CBNPC sur l’effet du traitement en termes de survie globale a été réalisée.
Les résultats étaient en faveur de pémétrexed comparé au docétaxel dès lors que l’histologie n’était pas à prédominance épidermoïde (n = 399, 9.3 versus 8,0 mois, risque relatif ajusté = 0,78 ; 95% IC = 0,61- 1,00, p = 0,047) et en faveur du docétaxel dès lors que l’histologie était de type carcinome à cellules épidermoïdes (n = 172, 6,2 versus 7,4 mois, risque relatif ajusté = 1,56; 95% IC = 1,08-2,26, p = 0,018). Aucune différence cliniquement significative n’était observée entre les sous-groupes histologiques concernant le profil de sécurité du pémétrexed.
Des données cliniques limitées d’une étude à part, de phase 3, contrôlée, suggèrent que les données d’efficacité (survie globale, survie sans progression) de pémétrexed sont similaires entre les patients précédemment prétraités par docétaxel (n = 41) et les patients n’ayant pas reçu de traitement antérieur par docétaxel (n = 540).
Tableau 6. Résultats d’efficacité du pémétrexed versus docétaxel dans le CBNPC - Population en Intention de Traiter
|
|
Pémétrexed |
Docétaxel |
|
Survie (mois) |
(n = 283) |
(n = 288) |
|
Médiane (mois) |
8,3 |
7,9 |
|
IC 95 % pour la médiane |
(7,0 - 9,4) |
(6,3 - 9,2) |
|
Risque relatif |
0,99 |
|
|
IC 95 % pour le risque relatif |
(0,82 - 1,20) |
|
|
Test de Non-inferiorité (risque relatif) valeur du p |
0,226 |
|
|
Survie sans Progression (mois) |
(n = 283) |
(n = 288) |
|
Médiane |
2,9 |
2,9 |
|
Risque relatif (IC 95 %) |
0,97 (0,82 – 1,16) |
|
|
Temps jusqu’à échec du traitement (mois) |
(n = 283) |
(n = 288) |
|
Médian |
2,3 |
2,1 |
|
Risque relatif (95 % CI) |
0,84 (0,71 - 0,997) |
|
|
Réponse (n : qualifié pour la réponse) |
(n = 264) |
(n = 274) |
|
Taux de réponse (%) (IC 95 %) |
9,1 (5,9 - 13,2) |
8,8 (5,7 - 12,8) |
|
Maladie stable (%) |
45,8 |
46,4 |
Abréviations : IC = intervalle de confiance; n = population totale.
CBNPC, traitement en première ligne
Une étude clinique de phase 3 multicentrique, randomisée, en ouvert comparant le pémétrexed plus cisplatine versus gemcitabine plus cisplatine chez les patients chimio naïfs atteints de CBNPC localement avancé ou métastatique (stade IIIb ou IV) a montré que pémétrexed plus cisplatine (population en Intention de Traiter (ITT) n = 862) avait atteint son objectif principal et montrait une efficacité clinique similaire à la gemcitabine plus cisplatine (population en ITT n = 863) en survie globale (risque relatif ajusté 0,94 ; 95 % IC = 0,84 - 1,05). Tous les patients inclus dans cette étude avaient un Performance Status ECOG de 0 ou 1.
L’analyse primaire d’efficacité était basée sur la population en ITT. Les analyses de sensibilité des principaux critères d’efficacité ont été également évaluées sur la population Qualifiée au Protocole (QP). Les analyses d’efficacité utilisant la population QP sont en accord avec celles utilisant la population en ITT et soutiennent la non-infériorité du pémétrexed-cisplatine versus gemcitabine-cisplatine.
La survie sans progression (SSP) et le taux de réponse globale étaient similaires entre les bras de traitement : la médiane de la SSP était de 4,8 mois pour pémétrexed plus cisplatine versus 5,1 mois pour gemcitabine plus cisplatine (risque relatif ajusté 1,04 ; 95 % IC = 0,94 - 1,15), et le taux de réponse globale était de 30,6 % (95 % IC = 27,3 - 33,9) pour pémétrexed plus cisplatine versus 28,2 % (95 % IC = 25,0 - 31,4) pour gemcitabine plus cisplatine. Les données sur la SSP étaient partiellement confirmées par une revue indépendante (400/1 725 patients étaient sélectionnés au hasard pour cette revue).
L’analyse de l’impact de l’histologie du CBNPC sur la survie globale a démontré des différences cliniquement pertinentes en terme de survie en fonction de l’histologie, voir tableau ci-dessous.
Tableau 7. Résultats d’efficacité du pémétrexed + cisplatine versus gemcitabine + cisplatine en première ligne de traitement du cancer bronchique non à petite cellule – population en ITT et sous-groupes histologiques.
|
Population en ITT et sous- groupes histologiques |
Médiane de survie globale en mois (95 % IC) |
Risque relatif ajusté (95 % IC) |
Supériorité valeur p |
|||
|
Pémétrexed + cisplatine |
Gemcitabine + cisplatine |
|||||
|
Population en ITT (N = 1 725) |
10,3 (9,8 – 11,2) |
N = 862 |
10,3 (9,6 – 10,9) |
N = 863 |
0,94a (0,84 – 1,05) |
0,259 |
|
Adenocarcinome (N = 847) |
12,6 (10,7 – 13,6) |
N = 436 |
10,9 (10,2 – 11,9) |
N = 411 |
0,84 (0,71 – 0,99) |
0,033 |
|
Grandes cellules (N = 153) |
10,4 (8,6 – 14,1) |
N = 76 |
6,7 (5,5 – 9,0) |
N = 77 |
0,67 (0,48 – 0,96) |
0,027 |
|
Autre (N = 252) |
8,6 (6,8 – 10,2) |
N = 106 |
9,2 (8,1 – 10,6) |
N = 146 |
1,08 (0,81 – 1,45) |
0,586 |
|
Cellules squameuses (N = 473) |
9,4 (8,4 – 10,2) |
N = 244 |
10,8 (9,5 – 12,1) |
N = 229 |
1,23 (1,00 – 1,51) |
0,050 |
Abréviations : IC : intervalle de confiance ; ITT : Population en Intention de Traiter ; N = taille population totale.
a statistiquement significatif pour la non-infériorité, un intervalle de confiance entier pour le risque relatif bien en-dessous de 1,17645 fois la marge de non-infériorité (p < 0,001).
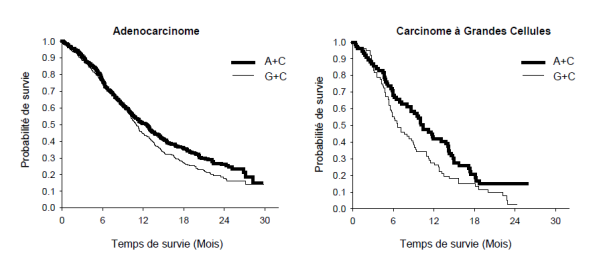
Graphique de Kaplan Meier sur la survie globale par histologie

A+C: Pémétrexed + Cisplatine
G+C: Gemcitabine + Cisplatine
Aucune différence cliniquement significative n’était observée entre les sous-groupes histologiques concernant le profil de sécurité de pémétrexed plus cisplatine. Les patients traités avec pémétrexed et cisplatine nécessitaient moins de transfusions (16,4 % versus 28,9 %, p < 0,001), de transfusions de globules rouges (16,1 % versus 27,3 %, p < 0,001) et de transfusions de plaquettes (1,8 % versus 4,5 %, p = 0,002). Les patients nécessitaient également une administration moindre d’érythropoïetine/ darbopoïetine (10,4 % versus 18,1 %, p < 0,001), GCSF/GM-CSF (3,1 % versus 6,1 %, p = 0,004), et de préparations à base de fer (4,3 % versus 7,0 %, p = 0,021).
CBNPC, traitement de maintenance
JMEN
Une étude clinique de phase 3 (JMEN) multicentrique, randomisée, en double-aveugle, contrôlée versus placebo, a comparé l’efficacité et la sécurité du traitement de maintenance par pémétrexed plus meilleurs soins de support (BSC) (n = 441) par rapport au placebo plus meilleurs soins de support (BSC) (n = 222) chez des patients atteints de cancer bronchique non à petites cellules localement avancé (stade IIIB) ou métastatique (stade IV) dont la maladie n’a pas progressé après 4 cycles de traitement en première ligne avec un doublet contenant du cisplatine ou du carboplatine en association avec la gemcitabine, le paclitaxel, ou le docétaxel. Le doublet en traitement de première ligne contenant pémétrexed n’était pas inclus. Tous les patients inclus dans cette étude avaient un Performance Status ECOG de 0 ou 1. Les patients ont reçu le traitement de maintenance jusqu’à progression de la maladie. L’efficacité et la sécurité ont été évaluées dès randomisation après avoir complété le traitement en première ligne (induction). La médiane du nombre de cycles reçus par les patients a été de 5 cycles dans le bras pémétrexed et de 3,5 dans le bras placebo. Un total de 213 patients (48,3 %) a complété ≥ 6 cycles de traitement et un total de 103 patients (23,4 %) a complété ≥ 10 cycles de traitement avec pémétrexed.
L’étude a atteint son objectif principal et a montré une amélioration statistiquement significative en SSP dans le bras pémétrexed par rapport au bras placebo (n = 581, population revue indépendamment ; médiane de 4,0 mois et 2,0 mois, respectivement) (risque relatif = 0,60, 95 % IC : 0,49 - 0,73, p < 0,00001). La revue indépendante des scanners des patients a confirmé les conclusions de l’évaluation faite par l’investigateur concernant la SSP. La survie globale médiane pour la population globale (n = 663) était de 13,4 mois pour le bras pémétrexed et 10,6 mois pour le bras placebo, risque relatif = 0,79 (95 % IC = 0,65 - 0,95 ; p = 0,01192).
En accord avec les autres études cliniques avec pémétrexed, une différence en termes d’efficacité en fonction de l’histologie du CBNPC a été observée dans l’étude JMEN. Pour les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde (n = 430, population revue indépendamment) la SSP médiane était de 4,4 mois pour le bras pémétrexed et de 1,8 mois pour le bras placebo, risque relatif = 0,47 (95 % IC = 0,37 – 0,60, p = 0,00001). La survie globale médiane pour les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde (n = 481) était de 15,5 mois pour le bras pémétrexed et 10,3 mois pour le bras placebo, risque relatif = 0,70 (95 % IC = 0,56-0,88, p = 0,002).
En incluant la phase d’induction, la survie globale médiane chez les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde était de 18,6 mois pour le bras pémétrexed et 13,6 mois pour le bras placebo, risque relatif = 0,71 (95 % IC = 0,56-0,88, p = 0,002).
Les résultats sur la SSP et la survie globale chez les patients avec une histologie de type épidermoïde n’ont suggéré aucun avantage pour pémétrexed par rapport au placebo.
Il n’y a pas eu de différences cliniquement pertinentes observées concernant le profil de sécurité de pémétrexed au sein des sous-groupes histologiques.
JMEN : Graphique de Kaplan Meier sur la survie sans progression (SSP) et la survie globale versus placebo chez les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde :
|
|
PARAMOUNT
Une étude clinique de phase 3 (PARAMOUNT) multicentrique, randomisée, en double-aveugle, contrôlée versus placebo, a comparé l’efficacité et la sécurité de pémétrexed poursuivi en traitement de maintenance plus meilleurs soins de support (BSC) (n = 359) par rapport au placebo plus meilleurs soins de support (BSC) (n = 180) chez des patients atteints de CBNPC localement avancé (stade IIIB) ou métastatique (stade IV) dès lors que l’histologie n’est pas à prédominance épidermoïde et dont la maladie n’a pas progressé après 4 cycles de traitement en première ligne avec un doublet pémétrexed associé au cisplatine. Parmi les 939 patients traités par pémétrexed plus cisplatine en induction, 539 patients ont été randomisés pour un traitement de maintenance par pémétrexed ou par placebo. Parmi les patients randomisés, 44,9 % avaient une réponse complète ou partielle et 51,9 % avaient une maladie stable suite au traitement pémétrexed plus cisplatine en induction. Les patients randomisés pour le traitement de maintenance devaient avoir un Performance Status ECOG de 0 ou 1. La durée médiane entre le début du traitement pémétrexed plus cisplatine en induction et le début du traitement de maintenance était de 2,96 mois pour les deux bras de traitement (bras pémétrexed et bras placebo). Les patients randomisés ont reçu le traitement de maintenance jusqu'à progression de la maladie. L’efficacité et la sécurité ont été évaluées à partir de la randomisation après avoir complété le traitement en première ligne (induction). Les patients ont reçu une médiane de 4 cycles de traitement de maintenance avec pémétrexed et 4 cycles de placebo. Un total de 169 patients (47,1 %) ont reçu au moins 6 cycles de pémétrexed en traitement de maintenance, ce qui représente un total d’au moins 10 cycles de pémétrexed.
L’étude a atteint son objectif principal et a montré une amélioration statistiquement significative de la Survie Sans Progression (SSP) dans le bras pémétrexed par rapport au bras placebo (n = 472, revue indépendante de la population ; médianes respectives de 3,9 mois et 2,6 mois) (risque relatif = 0,64, IC à 95 % : 0,51 - 0,81, p = 0,0002). La revue indépendante des scanners des patients a confirmé les conclusions de l’évaluation faite par l’investigateur concernant la SSP.
Pour les patients randomisés, la SSP médiane évaluée par l’investigateur, mesurée depuis le début du traitement par pémétrexed plus cisplatine en induction, était de 6,9 mois pour le bras pémétrexed et 5,6 mois pour le bras placebo (risque relatif = 0,59, IC à 95 % : 0,47 - 0,74).
Suite à un traitement d’induction avec pémétrexed plus cisplatine (4 cycles), le traitement par pémétrexed était statistiquement supérieur au placebo pour la Survie Globale (SG) (médiane de 13,9 mois versus 11,0 mois, HR = 0,78, 95%IC=0,64-0,96, p=0,0195).
Au moment de l’analyse finale de la survie, 28,7% des patients étaient en vie ou perdus de vue dans le bras pémétrexed versus 21,7% dans le bras placebo. L’effet relatif du traitement par pémétrexed était constant au sein des sous-groupes (incluant le stade de la maladie, la réponse à l’induction, le Performance Status ECOG, le statut de fumeur, le sexe, l’histologie et l’âge) et similaire à celui observé dans les analyses de SG et SSP non ajustées. Les taux de survie à 1 an et à 2 ans des patients sous pémétrexed étaient de 58% et 32% respectivement, comparés à 45% et 21% pour les patients sous placebo.
Depuis le début du traitement d’induction de première ligne avec pémétrexed plus cisplatine, la SG médiane des patients était de 16,9 mois pour le bras pémétrexed et de 14,0 mois pour le bras placebo (HR=0,78, 95%IC=0,64-0,96). Le pourcentage des patients ayant reçu un traitement après l’étude était de 64,3% pour pémétrexed et 71,7% pour le placebo.
PARAMOUNT : Graphique de Kaplan Meier sur la survie sans progression (SSP) et la survie globale (SG) pour pémétrexed poursuivi en maintenance versus placebo chez les patients atteints de CBNPC dès lors que l’histologie n’est pas à prédominance épidermoïde (mesurée depuis la randomisation) :
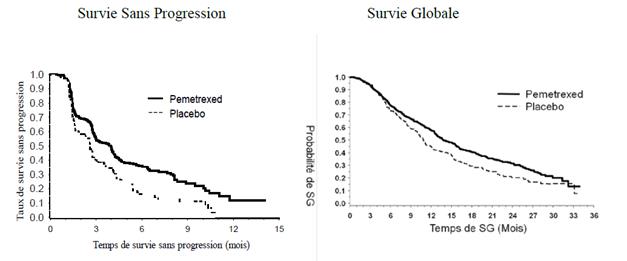
Les profils de sécurité du pémétrexed en maintenance dans les 2 études JMEN et PARAMOUNT étaient similaires.
5.2. Propriétés pharmacocinétiques
L’exposition systémique totale (aire sous la courbe - AUC) et la concentration maximale (Cmax) augmentent proportionnellement à la dose. Les caractéristiques pharmacocinétiques du pémétrexed sont constantes d’un cycle à l’autre.
Les paramètres pharmacocinétiques du pémétrexed ne sont pas influencés par l’administration concomitante de cisplatine. La supplémentation en acide folique par voie orale et en vitamine B12 par voie intramusculaire n’affecte pas la pharmacocinétique du pémétrexed.
5.3. Données de sécurité préclinique
L'administration de pémétrexed chez des souris mâles a eu des effets toxiques sur la reproduction, caractérisés par une réduction de la fertilité et par une atrophie testiculaire. Dans une étude conduite chez le chien beagle avec injection de bolus intraveineux pendant 9 mois, des effets sur les testicules (dégénérescence/nécrose de l'épithelium séminifère) ont été observés. Cela suggère que le pémétrexed peut altérer la fertilité masculine. La fertilité féminine n’a pas été étudiée.
Le pémétrexed n'a pas montré de potentiel mutagène que ce soit dans le test d'induction d'aberrations chromosomiques in vitro sur cellules d'ovaire de hamster chinois (CHO) ou dans le test d'Ames. Le pémétrexed s'est montré clastogène dans le test in vivo sur micronoyaux de souris.
Il n'a pas été conduit d'étude sur le potentiel carcinogène du pémétrexed.
Ce médicament est prêt à l'emploi et ne doit pas être mélangé à d'autres médicaments.
2 ans
6.4. Précautions particulières de conservation
Conserver dans l'emballage d'origine afin de le protéger de la lumière.
Poche de perfusion retirée du suremballage
La stabilité physicochimique et en cours d'utilisation du pémetrexed dans la poche de perfusion une fois retirée du suremballage a été démontrée pendant 30 jours à température ambiante si elle est protégée de la lumière et pendant 7 jours à température ambiante si elle n'est pas protégée de la lumière.
Conserver la poche de perfusion dans le carton extérieur afin de la protéger de la lumière.
Poche de perfusion après rupture du bouchon
D'un point de vue microbiologique, le produit doit être utilisé immédiatement, les durées de conservation et conditions avant utilisation relèvent de la responsabilité de l'utilisateur et ne devraient pas dépasser 24 heures à température ambiante, sauf si une technique aseptique est utilisée pour le dopage de la tubulure de perfusion stérile pour l'administration IV.
6.5. Nature et contenu de l'emballage extérieur
PEMETREXED SUN 5 mg/mL, 6 mg/mL, 6.5 mg/mL, 7 mg/mL, 7.5 mg/mL, 8 mg/mL, 8,5 mg/mL, 9 mg/mL, 10 mg/mL, et 11 mg/mL, solution pour perfusion est fourni stérile dans des sacs à perfusion flexibles multicouches non-PVC (structure du film : VMPET /ad/ (LLDPE /tie/ Active Barrier /tie/ LLDPE) /ad/ (HDPE / LLDPE / COP / LLDPE / HDPE) suremballée d'une poche en aluminium avec un piège à oxygène de 200 cc. Le bouchon de la poche de perfusion Minitulipe (Polycarbonate Minitulipe M95A spike port) est constitué d'un orifice à pointe avec un joint en chlorobutyle (sans latex) 6321 GS, et une tubulure de connexion RFT en polyoléfine est utilisée.
PEMETREXED SUN 5 mg/mL, 6 mg/mL, 6.5 mg/mL, 7 mg/mL, 7.5 mg/mL, 8 mg/mL, 8,5 mg/mL, 9 mg/mL, 10 mg/mL, et 11 mg/mL, solution pour perfusion est fourni stérile dans des poches de perfusion flexibles multicouches non-PVC (structure du film : VMPET /ad/ (LLDPE /tie/ Active Barrier / tie/ LLDPE) /ad/ (HDPE / LLDPE / COP / LLDPE / HDPE) suremballée d'une poche en aluminium avec une fenêtre transparente avec un piégeur d'oxygène de 200 cc et un indicateur d'oxygène. Le bouchon de la poche de perfusion minitulipe est constitué d'un orifice en pointe de la Minitulipe M95A en polycarbonate avec un joint 6321 GS en chlorobutyle (sans latex), et une tubulure de raccordement RFT en polyoléfine est utilisée.
Des codes de couleurs différents sont utilisés pour imprimer les différents dosages sur le suremballage, pour aider à différencier les dosages du produit sont les suivants.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PEMETREXED SUN, solution pour perfusion est conditionné dans des cartons contenant chacun 1 ou 5 poches de perfusion unidoses de 100 mL.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Manipulation
· calculez la dose et décidez du dosage de la poche de perfusion de PEMETREXED SUN dont vous avez besoin
· Vérifiez que l'emballage du produit n'est pas endommagé. Ne pas utiliser s'il y a des signes d'altération.
· appliquez l'étiquette spécifique au patient sur le suremballage.
Retrait de la poche de perfusion du suremballage et inspection de la poche de perfusion
· pour les suremballages avec fenêtre : utiliser le médicament si la couleur de l'indicateur d'oxygène est rose avant l'ouverture du suremballage pour retirer la poche de perfusion ; ne pas utiliser le médicament si la couleur de l'indicateur d'oxygène est bleue avant l'ouverture du suremballage (l'indicateur d'oxygène est présent dans les poches suremballées avec un sachet en aluminium avec une fenêtre transparente).
· déchirer le suremballage au niveau de l'encoche. Ne pas utiliser si le suremballage a déjà été ouvert ou endommagé.
· retirer la poche de perfusion du suremballage
· utiliser uniquement si la poche de perfusion et le sceau sont intacts. Avant l'administration, vérifiez qu'il n'y a pas d'infimes fuites en pressant fermement la poche. Si des fuites sont constatées, jeter la poche et la solution car la stérilité peut être altérée.
· les médicaments parentéraux doivent être inspectés visuellement avant l'administration afin de détecter toute particule ou décoloration. Si des particules sont observées, ne pas administrer.
Administration
· briser le sceau du bouchon en exerçant une pression sur un côté avec la main
· en utilisant une technique aseptique, fixer le dispositif d'administration stérile.
· se référer au mode d'emploi accompagnant le dispositif d'administration.
Précautions d'emploi
· ne pas utiliser en série
· ne pas introduire d'additifs dans la poche de perfusion
· la solution pour perfusion est prête à l'emploi et ne doit pas être mélangée à d'autres médicaments.
· PEMETREXED SUN solution pour perfusion est à usage unique. Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences locales.
Comme pour les autres agents anticancéreux potentiellement toxiques, il convient d'être prudent lors de la manipulation de PEMETREXED SUN en solution pour perfusion. L'utilisation de gants est recommandée. Si une solution de pémetrexed entre en contact avec la peau, laver immédiatement et soigneusement la peau avec de l'eau et du savon. Si les solutions de pémetrexed entrent en contact avec les muqueuses, rincez abondamment à l'eau. Le pémetrexed n'est pas un vésicant. Il n'existe pas d'antidote spécifique à l'extravasation du pémetrexed. Quelques cas d'extravasation de pémetrexed ont été rapportés, qui n'ont pas été évalués comme graves par l'investigateur. L'extravasation doit être prise en charge par la pratique standard locale comme pour les autres produits non vésicants.
Élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément aux exigences locales relatives aux agents cytotoxiques.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
SUN PHARMACEUTICAL INDUSTRIES EUROPE B.V.
POLARISAVENUE 87
2132 JH HOOFDDORP
PAYS-BAS
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 302 427 1 1 : 100 mL en poche (PEHD). Boîte de 1.
· 34009 550 857 7 5 : 100 mL en poche (PEHD). Boîte de 5.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Liste I
Médicament soumis à prescription hospitalière.
Prescription réservée aux spécialistes en oncologie ou en hématologie ou aux médecins compétents en cancérologie.
Médicament nécessitant une surveillance particulière pendant le traitement.