RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
ANSM - Mis à jour le : 13/02/2025
1. DENOMINATION DU MEDICAMENT
FLUARIX suspension injectable en seringue préremplie
Vaccin grippal trivalent (à virion fragmenté, inactivé)
2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Virus de la grippe (inactivé, fragmenté) des souches suivantes* :
A/Victoria/4897/2022 (H1N1)pdm09 - souche analogue (A/Victoria/4897/2022, IVR-238)
15 microgrammes HA**
A/Thailand/8/2022 (H3N2) - souche analogue (A/Thailand/8/2022, IVR-237)
15 microgrammes HA**
B/Austria/1359417/2021 - souche analogue (B/Austria/1359417/2021, BVR-26)
15 microgrammes HA**
Pour une dose de 0,5 mL
*cultivées sur œufs embryonnés de poules provenant d’élevages sains
**hémagglutinine
Ce vaccin est conforme aux recommandations de l'Organisation Mondiale de la Santé (OMS) (dans l'Hémisphère Nord) et à la recommandation de l’Union Européenne pour la saison 2024/2025.
FLUARIX peut contenir des traces d’ovalbumine, d’hydrocortisone, de sulfate de gentamicine, de formaldéhyde, de désoxycholate de sodium, utilisés lors du procédé de fabrication (voir rubrique 4.3).
Excipients à effet notoire :
Le vaccin ne contient pas plus de 0,415 mg de polysorbate 80 par dose (voir rubrique 4.4).
Pour la liste complète des excipients, voir rubrique 6.1.
3. FORME PHARMACEUTIQUE
Suspension injectable en seringue préremplie.
La suspension est incolore et légèrement opalescente.
4. DONNEES CLINIQUES
4.1. Indications thérapeutiques
FLUARIX est indiqué dans l'immunisation active des adultes et des enfants à partir de l’âge de 6 mois pour prévenir la grippe causée par deux sous-types de virus grippal A et une lignée de virus grippal B contenus dans le vaccin (voir rubrique 5.1).
L’utilisation de FLUARIX doit se baser sur les recommandations officielles.
4.2. Posologie et mode d'administration
Posologie
Adultes
Une dose de 0,5 mL.
Population pédiatrique
Enfants âgés de 6 mois à 17 ans : une dose de 0,5 mL.
Chez les enfants âgés de 6 mois à moins de 9 ans n'ayant pas été vaccinés auparavant, une seconde dose de 0,5 mL devra être injectée après un intervalle d'au moins 4 semaines.
La sécurité et l’efficacité de FLUARIX chez les enfants de moins de 6 mois n’ont pas été établies.
Mode d’administration
L’administration de FLUARIX doit se faire par voie intramusculaire, de préférence dans le muscle deltoïde ou dans la partie antérolatérale de la cuisse (en fonction de la masse musculaire).
Précautions à prendre avant la manipulation ou l’administration du vaccin :
Pour les instructions de préparation du médicament avant administration, voir rubrique 6.6.
4.3. Contre-indications
Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1 ou à tout composant pouvant être présent dans le vaccin à l’état de traces tel que l’ovalbumine, l’hydrocortisone, le sulfate de gentamicine, le formaldéhyde ou le désoxycholate de sodium.
4.4. Mises en garde spéciales et précautions d'emploi
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Avant l’immunisation
Conformément aux bonnes pratiques cliniques, la vaccination doit être précédée d’une évaluation des antécédents médicaux (en particulier des vaccinations antérieures et de l’éventuelle apparition d’effets indésirables) et d’un examen clinique.
Comme pour tous les vaccins injectables, il est recommandé de disposer d’un traitement médical approprié et d’assurer une surveillance en cas d'une éventuelle réaction anaphylactique suivant l'administration du vaccin.
Une syncope (évanouissement) peut survenir après toute vaccination, voire même avant, en particulier chez les adolescents, comme réaction psychogène à l’injection avec une aiguille. Ceci peut s’accompagner de plusieurs signes neurologiques comme un trouble transitoire de la vision, des paresthésies et des mouvements tonico-cloniques des membres durant la phase de récupération. Il est important que des mesures soient mises en place afin d’éviter des blessures en cas d’évanouissement.
Comme pour tout vaccin, l’administration de FLUARIX doit être différée chez les patients présentant une maladie fébrile aiguë jusqu’à résolution de la fièvre. La présence d'une infection mineure, comme un rhume, ne devrait pas entraîner le report de la vaccination.
FLUARIX vise à assurer une protection contre les souches de virus à partir desquelles le vaccin est préparé et contre les souches étroitement apparentées. FLUARIX peut ne pas être efficace contre toutes les souches possibles du virus de la grippe.
Comme pour tout vaccin, une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés.
Précautions d’emploi
FLUARIX ne doit pas être administré par voie intravasculaire.
Comme avec les autres vaccins administrés par voie intramusculaire, FLUARIX doit être administré avec prudence chez les sujets présentant une thrombocytopénie ou un trouble de la coagulation en raison du risque de saignement qui peut survenir après administration intramusculaire chez ces sujets.
Médicaments immunosuppresseurs systémiques et immunodéficience
On peut s'attendre à ce que chez les patients recevant un traitement immunosuppresseur ou les personnes immunodéficientes, une réponse immunitaire adéquate ne soit pas déclenchée.
Interférence avec les tests sérologiques
Des tests sérologiques ELISA faussement positifs pour le VIH-1, l'hépatite C et surtout le HTLV-1 peuvent être observés après une vaccination contre la grippe. Ces résultats faussement positifs transitoires peuvent être dus à des IgM réactives croisées induites par le vaccin. Pour cette raison, le diagnostic définitif d'infection par le VIH-1, l'hépatite C ou le HTLV-1 nécessite un résultat positif obtenu par un test de confirmation spécifique au virus (par exemple, Western Blot ou immunoblot ou PCR).
Excipients
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu’il est essentiellement « sans sodium ».
Ce médicament contient moins de 1 mmol (39 mg) de potassium par dose, c'est-à-dire qu’il est essentiellement « sans potassium ».
Le vaccin ne contient pas plus de 0,415 mg de polysorbate 80 par dose (voir rubrique 4.4). Les polysorbates peuvent provoquer des réactions allergiques.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions
La co-administration de vaccins a été évaluée dans des études menées avec FLUARIXTETRA (vaccin quadrivalent contre la grippe).
Si FLUARIX doit être administré en même temps que d’autres vaccins injectables, les vaccins doivent toujours être administrés en des sites d’injection différents.
Des données montrant que FLUARIX peut être administré en même temps que d’autres vaccins sont disponibles pour les vaccins suivants : un vaccin pneumococcique polyosidique (chez les sujets âgés de 50 ans et plus), un vaccin contre le zona avec adjuvant (Shingrix) ou un vaccin à acide ribonucléique messager (ARNm) contre l’infection à coronavirus 2019 (COVID-19) (voir rubrique 5.1).
La fréquence de la douleur au site d’injection rapportée chez les sujets vaccinés simultanément avec FLUARIXTETRA et un vaccin pneumococcique polyosidique à 23 valences (PP23) est similaire à celle observée avec le vaccin PP23 seul. Cette fréquence est plus élevée que celle observée avec le vaccin FLUARIXTETRA seul.
L’incidence de la fatigue, des céphalées, des myalgies, des arthralgies, des symptômes gastro-intestinaux (incluant : nausées, vomissements, diarrhées et/ou douleurs abdominales) et des frissons rapportés chez les sujets vaccinés simultanément avec FLUARIXTETRA et Shingrix est plus élevée que celle de FLUARIXTETRA seul.
L'incidence des événements indésirables sollicités rapportés chez les sujets vaccinés simultanément avec FLUARIXTETRA et l'ARNm COVID-19 est similaire à celle observée avec l'ARNm COVID-19 seul, et plus élevée par rapport à FLUARIXTETRA seul.
4.6. Fertilité, grossesse et allaitement
Grossesse
Les vaccins grippaux inactivés, tels que FLUARIX, peuvent être utilisés à tous les stades de la grossesse. Des données de sécurité plus importantes sont disponibles sur l’utilisation du vaccin au cours des deuxième ou troisième trimestres de grossesse, par rapport au premier trimestre.
La sécurité de FLUARIX lorsqu'il est administré aux femmes enceintes n'a pas été évaluée dans des essais cliniques. Les données disponibles après commercialisation sur FLUARIX n’indiquent pas d’issues défavorables de la grossesse.
Les études chez l’animal avec FLUARIX n'indiquent pas de toxicité directe ou indirecte en matière de reproduction et de développement (voir rubrique 5.3).
Les données de sécurité concernant l’utilisation pendant la grossesse des vaccins grippaux saisonniers inactivés dans le monde et une revue systématique de la littérature n’indiquent pas d’effets nocifs attribuables au vaccin, ni pour le fœtus, ni pour la mère.
Allaitement
On ne sait pas si FLUARIX est excrété dans le lait humain. Aucun effet négatif n’est attendu chez le nouveau-né/nourrisson allaité. FLUARIX peut être administré pendant l’allaitement.
Fertilité
Les études chez l’animal n'indiquent pas d'effets nocifs directs ou indirects en matière de fertilité chez les femelles.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines
Aucune étude sur les effets sur l'aptitude à conduire des véhicules et à utiliser des machines n'a été réalisée avec FLUARIX. Certains des effets mentionnés dans la rubrique Effets indésirables (par exemple, fatigue ou vertiges) peuvent temporairement avoir une influence mineure sur l'aptitude à conduire et à utiliser des machines.
4.8. Effets indésirables
Le profil de sécurité de FLUARIX actuellement approuvé a été établi à partir de FLUARIX précédemment approuvé.
Résumé du profil de sécurité
Pour les adultes, la plupart des réactions sollicitées survenaient généralement dans les 2 premiers jours suivant la vaccination, duraient 3 jours et étaient principalement rapportées comme étant d'intensité légère à modérée.
Pour les enfants âgés de 6 mois à 17 ans, la plupart des réactions sollicitées survenaient généralement le jour de la vaccination, duraient 2 jours et étaient principalement rapportées comme étant d'intensité légère à modérée.
Dans tous les groupes d'âge, la réaction indésirable locale la plus fréquemment rapportée après la vaccination était une douleur au site d'injection (21,5 % à 52,7 %).
Chez les adultes âgés de 18 ans et plus, les effets indésirables généraux les plus fréquemment rapportés après la vaccination étaient : fatigue (12,2 % à 31,4 %), céphalées (9,0 % à 21,9 %) et myalgies (12,2 % à 14,3 %).
Chez les sujets âgés de 6 ans à moins de 18 ans, les effets indésirables généraux les plus fréquemment rapportés après la vaccination étaient : fatigue (10,5 % à 16,7 %), myalgie (10,7 % à 24,6 %) et céphalées (9,3 % à 14,4 %).
Chez les sujets âgés de 3 ans à moins de 6 ans, les effets indésirables généraux les plus fréquemment rapportés après la vaccination étaient : somnolence (7,3 % à 14,8 %), perte d’appétit (5,5 % à 8,7 %) et irritabilité/agitation (8,1 % à 15,4 %).
Chez les sujets âgés de 6 mois à moins de 36 mois, les effets indésirables généraux les plus fréquemment rapportés après la vaccination étaient : irritabilité/agitation (19 % à 30,1 %), somnolence (13,5 % à 19,8 %) et perte d’appétit (7,5 % à 18 %).
Liste tabulée des effets indésirables
Les effets indésirables rapportés sont listés selon les catégories de fréquences suivantes :
Très fréquent (³ 1/10)
Fréquent (³ 1/100 à < 1/10)
Peu fréquent (≥ 1/1 000 à < 1/100)
Rare (≥ 1/10 000 à < 1/1 000)
Très rare (< 1/10 000)
Données cliniques
Dans des études cliniques contrôlées, FLUARIX a été administré à plus de 24 500 sujets âgés de 18 ans et plus et à plus de 8 600 sujets âgés de 6 mois à moins de 18 ans.
Les effets indésirables suivants ont été rapportés par dose de vaccin :
|
Classe de systèmes d’organes
|
Effets indésirables
|
Fréquence
|
|
6 à < 36 (mois)
|
3 à < 6 (ans)
|
6 à < 18 (ans)
|
≥ 18 ans
|
|
Trouble du métabolisme et de la nutrition
|
Perte d’appétit
|
Très fréquent
|
Très fréquent
|
N/A
|
N/R
|
|
Affections psychiatriques
|
Irritabilité
|
Très fréquent
|
Très fréquent
|
N/A
|
N/R
|
|
Affections du système nerveux
|
Céphalées
|
N/A
|
N/A
|
Très fréquent
|
Très fréquent
|
|
Somnolence
|
Très fréquent
|
Très fréquent
|
N/A
|
N/R
|
|
Etourdissement
|
N/R
|
N/R
|
N/R
|
Peu fréquent
|
|
Affections gastro-intestinales
|
Symptômes gastro-intestinaux (incluant : nausées, diarrhées, vomissements et/ou douleurs abdominales)
|
Fréquent
|
Fréquent
|
Fréquent
|
Fréquent
|
|
Affections de la peau et du tissu sous-cutané
|
Sueurs
|
N/R
|
N/R
|
N/R
|
Fréquent
|
|
Affections musculo-squelettiques et du tissu conjonctif
|
Myalgie
|
N/A
|
N/A
|
Très fréquent
|
Très fréquent
|
|
Arthralgie
|
N/A
|
N/A
|
Fréquent
|
Fréquent
|
|
Troubles généraux et anomalies au site d’administration
|
Fatigue
|
N/A
|
N/A
|
Très fréquent
|
Très fréquent
|
|
Frissons
|
N/A
|
N/A
|
Fréquent
|
Fréquent
|
|
Fièvre (≥ 38,0°C)
|
Fréquent
|
Fréquent
|
Fréquent
|
Peu fréquent
|
|
Douleur au site d’injection
|
Très fréquent
|
Très fréquent
|
Très fréquent
|
Très fréquent
|
|
Rougeur au site d’injection
|
Très fréquent
|
Très fréquent
|
Très fréquent
|
Fréquent
|
|
Gonflement au site d’injection
|
Très fréquent
|
Très fréquent
|
Très fréquent
|
Fréquent
|
|
Induration au site d’injection
|
N/R
|
N/R
|
N/R
|
Fréquent
|
N/A=Non sollicité dans ce groupe d’âge
N/R=Non rapporté
Données après commercialisation
|
Classe de systèmes d’organes
|
Fréquence
|
Effets indésirables
|
|
Affections hématologiques et du système lymphatique
|
Rare
|
Lymphadénopathie transitoire
|
|
Affections du système immunitaire
|
Rare
|
Réactions allergiques (incluant les réactions anaphylactiques)
|
|
Affections du système nerveux
|
Rare
|
Névrite, encéphalomyélite aiguë disséminée, syndrome de Guillain-Barré*
|
|
Affections de la peau et du tissu sous-cutané
|
Rare
|
Urticaire, prurit, érythème, rash, angiœdème
|
|
Troubles généraux et anomalies au site d’administration
|
Rare
|
Syndrome pseudo-grippal, malaise
|
*Des notifications spontanées de syndrome de Guillain-Barré ont été rapportées après vaccination avec FLUARIX. Cependant, une relation causale entre la vaccination et le syndrome de Guillain-Barré n’a pas été établie.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : https://signalement.social-sante.gouv.fr/.
4.9. Surdosage
Des données insuffisantes sont disponibles.
5. PROPRIETES PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Vaccins contre la grippe, code ATC : J07BB02.
Mécanisme d’action
FLUARIX permet une immunisation active contre trois souches du virus de la grippe contenues dans le vaccin.
FLUARIX induit des anticorps humoraux contre les hémagglutinines. Ces anticorps neutralisent les virus de la grippe.
Il n’a pas été établi de seuil en anticorps inhibant l'hémagglutination (IH) corrélé à une protection contre la grippe après la vaccination par les vaccins grippaux inactivés. Cependant, les titres en anticorps IH ont été utilisés comme mesure de l'activité vaccinale. Dans certaines essais de challenge chez l’Homme, des titres en anticorps IH 1:40 ont été associés à une protection contre la grippe chez jusqu’à 50 % des sujets.
La revaccination annuelle est conseillée car l'immunité diminue au cours de l'année suivant la vaccination, et parce que les souches circulantes du virus de la grippe peuvent changer d'une année à l'autre.
Effets pharmacodynamiques
Les données immunologiques ainsi que les estimations d’efficacité relatives à FLUARIX ont été obtenues à partir d’études conduites avec soit FLUARIX, soit FLUARIXTETRA.
Efficacité vaccinale
Efficacité chez les enfants âgés de 6 à 35 mois
L’efficacité de FLUARIXTETRA a été évaluée durant les saisons grippales 2011 à 2014 au cours de l’étude clinique D-QIV-004, un essai randomisé, investigateurs en aveugle, contrôlé versus des vaccins non-grippaux. Des sujets sains âgés de 6 à 35 mois ont été randomisés (1:1) afin de recevoir soit FLUARIXTETRA (N=6 006) soit un vaccin contrôle non-grippal (N=6 012). Une dose (en cas d’antécédent de vaccination contre la grippe) ou deux doses de vaccin leur ont été administrées, à environ 28 jours d’intervalle.
L’efficacité de FLUARIXTETRA a été évaluée dans la prévention de la grippe (grippe modérée à sévère et grippe toute intensité) A et/ou B confirmée par RT-PCR (Reverse Transcription Polymerase Chain Reaction - amplification en chaîne par la polymérase après transcription inverse) quelle que soit la souche grippale saisonnière. Deux semaines après la vaccination et jusqu’à la fin de la saison grippale (environ 6 mois plus tard), des prélèvements nasaux ont été collectés à la suite d’un épisode pseudo-grippal, et testés pour la grippe A et/ou B par RT-PCR. Tous les prélèvements positifs par RT-PCR ont été testés sur culture cellulaire pour évaluer la viabilité et déterminer si les souches étaient apparentées aux souches vaccinales.
FLUARIXTETRA a atteint les critères prédéfinis des objectifs principaux et secondaires d’efficacité vaccinale, données présentées dans le tableau 1.
Tableau 1 : FLUARIXTETRA : Taux d’attaque et efficacité vaccinale chez des enfants âgés de 6 à 35 mois (cohorte pour l’efficacité conforme au protocole [ATP] – temps jusqu’à l’évènement)
|
|
FLUARIXTETRA
|
Comparateur actif1
|
Efficacité vaccinale
|
|
N2=5 707
|
N2=5 697
|
|
n3
|
Taux d’attaque (n/N) (%)
|
n3
|
Taux d’attaque (n/N) (%)
|
%
|
IC
|
|
Grippe toute intensité6
|
|
Confirmée par RT-PCR
|
344
|
6,03
|
662
|
11,62
|
49,8
|
41,8 ; 56,84
|
|
Confirmée par culture
|
303
|
5,31
|
602
|
10,57
|
51,2
|
44,1 ; 57,65
|
|
Confirmée par culture, souches apparentées aux souches vaccinales
|
88
|
1,54
|
216
|
3,79
|
60,1
|
49,1 ; 69,05
|
|
Grippe modérée à sévère7
|
|
Confirmée par RT-PCR
|
90
|
1,58
|
242
|
4,25
|
63,2
|
51,8 ; 72,34
|
|
Confirmée par culture
|
79
|
1,38
|
216
|
3,79
|
63,8
|
53,4 ; 72,25
|
|
Confirmée par culture, souches apparentées aux souches vaccinales
|
20
|
0,35
|
88
|
1,54
|
77,6
|
64,3 ; 86,65
|
|
Maladie des voies respiratoires inférieures grippale confirmée par RT-PCR
|
28
|
0,49
|
61
|
1,07
|
54,0
|
28,9 ; 71,05
|
|
Otite moyenne aigüe confirmée par RT-PCR
|
12
|
0,21
|
28
|
0,49
|
56,6
|
16,7 ; 78,85
|
IC : Intervalle de confiance
1Enfants ayant reçu des vaccins contrôles non-grippaux adaptés à leur âge
2Nombre de sujets inclus dans la cohorte ATP testée pour l’efficacité – temps jusqu’à l’évènement. Cette cohorte a inclus les sujets remplissant tous les critères d’éligibilité, qui ont été suivis pour évaluer l’efficacité et respectant le protocole de l’étude jusqu’à la fin de l’épisode de grippe
3Nombre de sujets qui ont rapporté au moins un épisode de grippe durant la période de suivi
4Intervalle de confiance à 97,5 %
5Intervalle de confiance à 95 %
6Cas de grippe toute intensité définis comme un syndrome pseudo-grippal (syndrome défini par de la fièvre ≥ 38 °C associée à au moins un des symptômes suivants : toux, nez qui coule, congestion nasale ou difficulté respiratoire) ou la conséquence d’une infection grippale (otite moyenne aigüe ou maladie des voies respiratoires inférieures).
7Grippe modérée à sévère était une sous-catégorie des cas de grippe, avec présence d’au moins un des symptômes suivants : fièvre > 39°C, otite moyenne aigüe ou infection des voies respiratoires inférieures diagnostiquée par un médecin, complications extra-pulmonaires sévères diagnostiquées par un médecin, hospitalisation en soins intensifs ou nécessité d’un supplément en oxygène durant plus de 8 heures
Des analyses exploratoires ont été conduites sur la cohorte totale de sujets vaccinés, incluant 12 018 sujets (N=6 006 pour FLUARIXTETRA, N=6 012 pour le groupe contrôle). FLUARIXTETRA a été efficace dans la prévention de la grippe modérée à sévère causée par chacune des 4 souches (tableau 2), même quand il y avait une discordance antigénique significative pour 2 des 4 souches vaccinales (A/H3N2 et B/Victoria).
Tableau 2 : FLUARIXTETRA : Taux d’attaque et efficacité vaccinale contre la grippe modérée à sévère due à la grippe par type et sous-type A et par type et lignée B, confirmée par RT-PCR, chez des enfants âgés de 6 à 35 mois (cohorte totale de sujets vaccinées)
|
|
FLUARIXTETRA
|
Comparateur actif1
|
Efficacité vaccinale
|
|
|
N2=6 006
|
N2=6 012
|
|
Souche
|
n3
|
Taux d’attaque (n/N) (%)
|
n3
|
Taux d’attaque (n/N) (%)
|
%
|
IC 95 %
|
|
A
|
|
|
H1N14
|
13
|
0,22
|
46
|
0,77
|
72,1
|
49,9 ; 85,5
|
|
H3N25
|
53
|
0,88
|
112
|
1,86
|
52,7
|
34,8 ; 66,1
|
|
B
|
|
|
Victoria6
|
3
|
0,05
|
15
|
0,25
|
80,1
|
39,7 ; 95,4
|
|
Yamagata7
|
22
|
0,37
|
73
|
1,21
|
70,1
|
52,7 ; 81,9
|
IC : Intervalle de Confiance
1Enfants ayant reçu des vaccins contrôles non-grippaux adaptés à leur âge
2Nombre de sujets inclus dans la cohorte totale de sujets vaccinés
3Nombre de sujets ayant rapporté au moins un épisode de grippe modérée à sévère durant la période de suivi
4 à 7 La proportion de souches antigéniquement apparentées était respectivement de 84,8 %, 2,6 %, 14,3 % et 66,6 %, pour A/H1N1, A/H3N2, B/Victoria, et B/Yamagata
De plus, pour les cas de grippe toute intensité confirmée par RT-PCR, FLUARIXTETRA a diminué le risque de visites chez le médecin généraliste de 47 % (Risque Relatif (RR) : 0,53 [IC 95 % : 0,46 ; 0,61] soit 310 versus 583 visites) et aux urgences de 79 % (RR : 0,21 [IC 95 % : 0,09 ; 0,47] soit 7 versus 33 visites). L’utilisation d’antibiotiques a été diminuée de 50 % (RR : 0,50 [IC 95 % : 0,42 ; 0,60] soit pour 172 versus 341 sujets).
Efficacité chez l’adulte de 18 ans et plus
L'efficacité de FLUARIX a été évaluée dans l'étude clinique Fluarix-US-006, une étude randomisée, en double aveugle, contrôlée par placebo. L'étude a évalué l'efficacité chez 7 652 sujets (N=5 103 pour FLUARIX et N=2 549 pour le placebo) pour prévenir les cas de grippe A et/ou B confirmés par culture pour les souches antigéniquement correspondantes du vaccin.
Les sujets ont été surveillés pour des maladies de type grippal suivies de la grippe confirmée par culture (Tableau 3). Le syndrome pseudo-grippal était défini comme au moins un symptôme général (fièvre ≥ 37,8 °C et/ou myalgies) et au moins un symptôme respiratoire (toux et/ou maux de gorge).
Tableau 3 : Taux d'attaque et efficacité vaccinale contre la grippe A ou B confirmée chez des adultes de 18 à 64 ans (cohorte totale vaccinée)
|
|
Fluarix
|
Placebo
|
Efficacité vaccinale
|
|
N1=5 103
|
N1=2 549
|
|
n2
|
Taux d’attaque (n/N) (%)
|
n2
|
Taux d’attaque (n/N) (%)
|
%
|
IC 95 %
|
|
Grippe confirmée par culture, de souche antigéniquement apparentée3
|
49
|
1,0
|
74
|
2,9
|
66,9
|
51,9 ; 77,4
|
|
Toute grippe confirmée par culture (apparentée, non apparentée et non typée)4
|
63
|
1,2
|
82
|
3,2
|
61,6
|
46,0 ; 72,8
|
IC : Intervalle de Confiance
1nombre total de sujets
2 nombre de cas
3Aucun cas de grippe A/New Caledonia/20/1999 (H1N1) ou B/Malaysia/2506/2004, confirmé par culture, et antigéniquement apparenté, dans le groupe FLUARIX et placebo n’a été rapporté
4Sur les 22 cas supplémentaires, 18 étaient non apparentés et 4 étaient non typés ; 15 des 22 cas étaient de type A (H3N2) (11 cas dans le groupe FLUARIX et 4 dans le groupe placebo)
Données d’immunogénicité
L’immunogénicité de FLUARIXTETRA a été évaluée en termes de moyenne géométrique des titres (MGT) en anticorps IH et de taux de séroconversion IH (multiplication par au moins 4 des titres en anticorps ou titres ≥ 40 pour les sujets avec des titres indétectables [< 10] avant vaccination) (pour les enfants) et au Jour 21 (pour les adultes) 28 jours après la dernière dose.
Immunogénicité chez les enfants âgés de 6 à 35 mois
Dans l’étude D-QIV-004, l’évaluation a été menée sur un sous-groupe de 1 332 enfants (753 dans le groupe FLUARIXTETRA et 579 dans le groupe contrôle). Les résultats sont présentés dans le tableau 4.
Tableau 4 : FLUARIXTETRA : MGT post-vaccination et taux de séroconversion chez les enfants (âgés de 6 à 35 mois) (cohorte conforme au protocole)
|
|
FLUARIXTETRA
|
Contrôle3
|
|
N1=750-753
|
N2=742-746
|
N1=578-579
|
N2=566-568
|
|
MGT4 (IC 95 %)
|
Taux de séroconversion2
(IC 95 %)
|
MGT4 (IC 95 %)
|
Taux de séroconversion4
(IC 95 %)
|
|
A/H1N1
|
165,3
(148,6 ; 183,8)
|
80,2 % (77,2 ; 83,0)
|
12,6 (11,1 ; 14,3)
|
3,5 % (2,2 ; 5,4)
|
|
A/H3N2
|
132,1
(119,1 ; 146,5)
|
68,8 % (65,3 ; 72,1)
|
14,7 (12,9 ; 16,7)
|
4,2 % (2,7 ; 6,2)
|
|
B (Victoria)
|
92,6
(82,3 ; 104,1)
|
69,3 % (65,8 ; 72,6)
|
9,2 (8,4 ; 10,1)
|
0,9 % (0,3 ; 2,0)
|
|
B (Yamagata)
|
121,4
(110,1 ; 133,8)
|
81,2 % (78,2 ; 84,0)
|
7,6 (7,0 ; 8,3)
|
2,3 % (1,2 ; 3,9)
|
IC : Intervalle de Confiance
1Nombre de sujets avec des résultats post-vaccinaux disponibles (pour les MGT)
2Nombre de sujets avec des résultats pré- et post-vaccinaux disponibles (pour les taux de séroconversion)
3Vaccins contrôles non-grippaux
4Résultats sur la sous-cohorte d’immunogénicité
L’effet de la primovaccination par 2 doses de FLUARIXTETRA (administrées dans l’étude D-QIV 004) a été évalué en mesurant la réponse immunitaire après une nouvelle vaccination par une dose de FLUARIXTETRA, un an après (vaccination réalisée dans l’étude D-QIV-009). Cette étude a démontré que 7 jours après la vaccination, une mémoire immunitaire a été induite chez ces enfants de 6 à 35 mois pour les 4 souches vaccinales.
Immunogénicité chez les enfants âgés de 3 ans à moins de 18 ans
Dans une étude de phase III, en double aveugle (D-QIV-003), les enfants ont été randomisés pour recevoir 1 ou 2 doses (selon l'historique de vaccination contre la grippe) soit de FLUARIX (N=818) soit de FLUARIXTETRA (N=791). Les réponses immunitaires induites par FLUARIX et FLUARIXTETRA sont présentées dans le Tableau 5.
Tableau 5 : FLUARIXTETRA : MGT post-vaccination et taux de séroconversion chez les enfants (âgés de 3 à moins de 18 ans) (cohorte conforme au protocole)
|
|
FLUARIX3
|
FLUARIXTETRA
|
|
N1=818
|
N2=818
|
N1=791
|
N2=790
|
|
MGT (IC 95 %)
|
Taux de séroconversion
(IC 95 %)
|
MGT (IC 95 %)
|
Taux de séroconversion
(IC 95 %)
|
|
A/H1N1
|
433,2
(401,0 ; 468,0)
|
89,9 %
(87,6 ; 91,8)
|
386,2
(357,3 ; 417,4)
|
91,4 %
(89,2 ; 93,3)
|
|
A/H3N2
|
227,3
(213,3 ; 242,3)
|
70,7 %
(67,4 ; 73,8)
|
228,8
(215,0 ; 243,4)
|
72,3 %
(69,0 ; 75,4)
|
|
B (Victoria)
|
245,6
(229,2 ; 263,2)
|
68,5 %
(65,2 ; 71,6)
|
244,2
(227,5 ; 262,1)
|
70,0 %
(66,7 ; 73,2)
|
|
B (Yamagata)
|
224,7
(207,9 ; 242,9)
|
37,0 %
(33,7 ; 40,5)
|
569,6
(533,6 ; 608,1)
|
72,5 %
(69,3 ; 75,6)
|
IC : Intervalle de Confiance
1Nombre de sujets avec des résultats post-vaccinaux disponibles (pour les MGT)
2Nombre de sujets avec des résultats pré- et post-vaccinaux disponibles (pour les taux de séroconversion)
3 La souche B (Yamagata) n’était pas incluse dans FLUARIX
Immunogénicité chez les adultes âgés de 18 ans et plus
Dans une étude de phase III, randomisée et partiellement en aveugle (D-QIV-008), environ 600 sujets ont reçu 1 dose de FLUARIX et environ 1 800 sujets ont reçu 1 dose de FLUARIXTETRA. Les réponses immunitaires induites par FLUARIX et FLUARIXTETRA sont présentées dans le tableau 6.
Table 6: Post-vaccination GMT and seroconversion rates in adults 18 years or older (According to Protocol Cohort)
|
|
FLUARIX3
|
FLUARIXTETRA
|
|
N1=608
|
N2=605
|
N1=1 809
|
N2=1 801
|
|
MGT (IC 95 %)
|
Taux de séroconversion
(IC 95 %)
|
MGT (IC 95 %)
|
Taux de séroconversion
(IC 95 %)
|
|
A/H1N1
|
218,4
(194,2 ; 245,6)
|
77,2 %
(73,6 ; 80,5)
|
201,1
(188,1 ; 215,1)
|
77,5 %
(75,5 ; 79,4)
|
|
A/H3N2
|
298,2
(268,4 ; 331,3)
|
65,8 %
(61,9 ; 69,6)
|
314,7
(296,8 ; 333,6)
|
71,5 %
(69,3 ; 73,5)
|
|
B (Victoria)
|
393,8
(362,7 ; 427,6)
|
55,4 %
(51,3 ; 59,4)
|
404,6
(386,6 ; 423,4)
|
58,1 %
(55,8 ; 60,4)
|
|
B (Yamagata)
|
386,6
(351,5 ; 425,3)
|
45.6 %
(41,6 ; 49,7)
|
601,8
(573,3 ; 631,6)
|
61,7 %
(59,5 ; 64,0)
|
IC : Intervalle de Confiance
1Nombre de sujets avec des résultats post-vaccinaux disponibles (pour les MGT)
2Nombre de sujets avec des résultats pré- et post-vaccinaux disponibles (pour les taux de séroconversion)
3 La souche B (Yamagata) n’était pas incluse dans FLUARIX
Administration concomitante
Administration concomitante avec des vaccins pneumococciques
Dans l'étude clinique D-QIV-010 incluant 356 adultes âgés de 50 ans et plus, à risque de complications liées aux maladies grippales et pneumococciques, les sujets ont reçu FLUARIXTETRA et un vaccin pneumococcique polyosidique à 23 valences soit concomitamment, soit successivement. Pour les 4 souches de FLUARIXTETRA et 6 des sérotypes pneumococciques (1, 3, 4, 7F, 14 et 19A) du vaccin PPV23 évalués dans l’analyse principale pré-spécifiée au protocole, la réponse immunitaire était non inférieure entre les deux groupes de traitement.
La non-infériorité immunologique a été démontrée sur la base des données publiées pour les 3 souches de FLUARIX et pour tous les sérotypes du vaccin conjugué pneumococcique 13-valent (PCV13) chez les adultes de 50 à 59 ans, ainsi que pour 2 des 3 souches de FLUARIX et 12 des 13 sérotypes de PCV13 chez les adultes > 65 ans. Une réponse immunitaire plus faible à certains sérotypes pneumococciques a été observée lorsque le PCV13 était administré concomitamment avec FLUARIX par rapport à une administration séquentielle, cependant la portée clinique de cette observation est inconnue.
Co-administration avec le vaccin contre le zona avec adjuvant (Shingrix)
Dans l'étude clinique Zoster-004, 828 adultes âgés de 50 ans et plus ont été randomisés pour recevoir 2 doses de Shingrix à 2 mois d'intervalle, administrées avec une dose de FLUARIXTETRA, soit en même temps que la première dose (N=413), soit de manière non concomitante (N=415). La non-infériorité immunologique entre l'administration concomitante et non concomitante a été démontrée pour les quatre souches incluses dans FLUARIXTETRA en termes de MGT en anticorps IH.
Administration concomitante avec le vaccin à ARNm contre la COVID-19
Dans l’étude Zoster-091, 988 adultes âgés de 18 ans et plus ont reçu FLUARIXTETRA et une dose de rappel d’un vaccin à ARNm COVID-19 monovalent-1273 50 microgrammes (souche originale SARS-CoV-2), soit de façon concomitante (N=498), soit de façon non concomitante, à deux semaines d'intervalle (N=490). La non-infériorité immunologique entre l'administration concomitante et non concomitante a été démontrée pour les quatre souches incluses dans FLUARIXTETRA en termes de moyennes géométriques des titres (MGT) des anticorps anti-Hémagglutinine (IH), et pour la dose de rappel d’un vaccin à ARNm COVID-19 monovalent-1273 en termes de concentrations moyennes géométriques (CMG) des anticorps anti-protéine S.
5.2. Propriétés pharmacocinétiques
Sans objet.
5.3. Données de sécurité préclinique
Les données non cliniques ne révèlent aucun risque particulier pour l’Homme sur la base des études de sécurité générale.
Les études de reproduction et de développement avec FLUARIX n'ont révélé aucun effet lié au vaccin sur la fertilité féminine, la grossesse, ou le développement embryo-fœtal ou de la progéniture.
6. DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Chlorure de sodium, phosphate disodique dodécahydraté, phosphate monopotassique, chlorure de potassium, chlorure de magnésium hexahydraté, hydrogénosuccinate d’alpha tocophéryle, polysorbate 80, octoxinol 10, eau pour préparations injectables.
6.2. Incompatibilités
En l’absence d’études de compatibilité, ce médicament ne doit pas être mélangé avec d’autres médicaments.
6.3. Durée de conservation
1 an.
6.4. Précautions particulières de conservation
À conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
À conserver dans l’emballage extérieur d’origine, à l’abri de la lumière.
Les données de stabilité indiquent que FLUARIX est stable jusqu’à 25 °C pendant 72 heures. À la fin de cette période, le vaccin doit être utilisé ou jeté. Ces informations sont destinées à guider les professionnels de santé uniquement en cas d'excursion temporaire de température.
6.5. Nature et contenu de l'emballage extérieur
0,5 mL de suspension en seringue préremplie (verre de type I), munie d'un bouchon-piston (caoutchouc butyle) et d’un embout protecteur en caoutchouc.
L'embout protecteur et le bouchon-piston en caoutchouc de la seringue préremplie sont fabriqués avec du caoutchouc synthétique.
Boîtes de 1 et de 10, avec ou sans aiguille(s).
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation
Avant administration, le vaccin doit être inspecté visuellement pour mettre en évidence la présence de particules étrangères et/ou altération de l’aspect physique. Avant son utilisation, le vaccin doit être bien agité afin d’obtenir un liquide incolore et légèrement opalescent. Jeter si le contenu semble différent.
Le contenu de la seringue doit être injecté en entier.
Instructions d’utilisation de la seringue préremplie
|
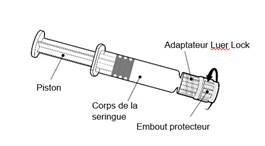
|
Tenir la seringue par le corps de la seringue et non par le piston.
Dévisser l’embout protecteur de la seringue en le tournant dans le sens inverse des aiguilles d’une montre.
|
|
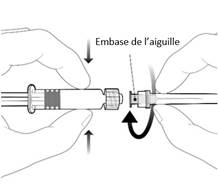
|
Pour fixer l’aiguille, connecter l’embase de l’aiguille sur l’adaptateur Luer Lock et tourner d’un quart de tour dans le sens des aiguilles d’une montre jusqu’à sentir un blocage.
Ne pas tirer le piston en dehors du corps de la seringue. Si cela se produit, ne pas administrer le vaccin.
|
Instructions d’élimination
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATOIRE GLAXOSMITHKLINE
23 rue François Jacob
92500 rueil-malmaison
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
· 34009 303 117 2 1 : 0,5 mL en seringue préremplie (verre) munie d'un bouchon-piston (butyle). Boîte de 1.
· 34009 303 117 3 8 : 0,5 mL en seringue préremplie (verre) munie d'un bouchon-piston (butyle). Boîte de 10.
· 34009 303 117 4 5 : 0,5 mL en seringue préremplie (verre) munie d'un bouchon-piston (butyle) avec 1 aiguille. Boîte de 1.
· 34009 303 117 5 2 : 0,5 mL en seringue préremplie (verre) munie d'un bouchon-piston (butyle) avec 2 aiguilles. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION
[à compléter ultérieurement par le titulaire]
Date de première autorisation:{JJ mois AAAA}
10. DATE DE MISE A JOUR DU TEXTE
[à compléter ultérieurement par le titulaire]
{JJ mois AAAA}
11. DOSIMETRIE
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES
Sans objet.
Médicament non soumis à prescription médicale.

